题目内容
(I)多项选择题
下列有关化工生产的说法中不正确的是
A.工业上用电解熔融的氯化物的方法制备金属镁和铝
B.适当提高合成氨原料气中N2的含量,可提高H2的转化率
C.从安全运输上看,硫酸厂靠近硫酸消费中心比靠近原料产地更为有利
D.利用反应NaCl(饱和)+CO2+NH3+H2O=NH4Cl+NaHCO3↓制取NaHCO3时,应在NaCl饱和溶液中先通入过量CO2再通入过量的NH3
E.硫酸厂生产时常采有高压条件提高SO2的转化率
(II)
过碳酸钠(2Na2CO3?3H2O2)俗称固体双氧水,被大量用于洗涤、印染、纺织、造纸、医药卫生等领域中.它的制备原理和路线如下:
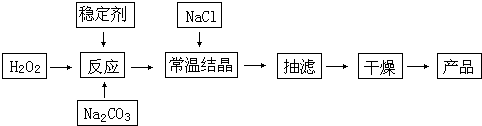
试回答下列问题:
(1)与过碳酸钠的用途相关的化学性质是
A.MnO2 B. H2S C.稀硫酸 D. NaHCO3
(2)加入NaCl的作用是
(3)工业纯碱中含有Fe3+等杂质,加入稳定剂的作用是与生成稳定的配合物.Fe3+的不良影响是
(4)反应的最佳温度控制在15~25℃,温度偏高时造成产率偏低的可能原因是
(5)有人想用过碳酸钠测定氢溴酸的浓度.若一定量的过碳酸钠与100mL氢溴酸溶液恰好完全反应,在标准状况下产生448mL气体,则所用氢溴酸的浓度为
下列有关化工生产的说法中不正确的是
ADE
ADE
A.工业上用电解熔融的氯化物的方法制备金属镁和铝
B.适当提高合成氨原料气中N2的含量,可提高H2的转化率
C.从安全运输上看,硫酸厂靠近硫酸消费中心比靠近原料产地更为有利
D.利用反应NaCl(饱和)+CO2+NH3+H2O=NH4Cl+NaHCO3↓制取NaHCO3时,应在NaCl饱和溶液中先通入过量CO2再通入过量的NH3
E.硫酸厂生产时常采有高压条件提高SO2的转化率
(II)
过碳酸钠(2Na2CO3?3H2O2)俗称固体双氧水,被大量用于洗涤、印染、纺织、造纸、医药卫生等领域中.它的制备原理和路线如下:

试回答下列问题:
(1)与过碳酸钠的用途相关的化学性质是
强氧化性
强氧化性
,下列四种物质可使过碳酸钠较快失效的是ABC
ABC
A.MnO2 B. H2S C.稀硫酸 D. NaHCO3
(2)加入NaCl的作用是
降低2Na2CO3?3H2O2溶解度,析出更多晶体
降低2Na2CO3?3H2O2溶解度,析出更多晶体
(3)工业纯碱中含有Fe3+等杂质,加入稳定剂的作用是与生成稳定的配合物.Fe3+的不良影响是
催化双氧水的分解
催化双氧水的分解
,反应方程式为2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.
| ||
(4)反应的最佳温度控制在15~25℃,温度偏高时造成产率偏低的可能原因是
温度高时双氧水易分解
温度高时双氧水易分解
,温度偏低时造成产率偏低的可能原因是温度低时反应慢
温度低时反应慢
,而该流程中还是遗漏了一步操作,造成产品产率偏低,这步操作名称是洗涤
洗涤
.(5)有人想用过碳酸钠测定氢溴酸的浓度.若一定量的过碳酸钠与100mL氢溴酸溶液恰好完全反应,在标准状况下产生448mL气体,则所用氢溴酸的浓度为
1
1
mol/L.(已知:H2O2+2HBr=Br2+2H2O)分析:(Ⅰ)A、因为氯化铝是共价化合物,所以熔融时,它是不导电的,所以只能去电解氧化铝;
B、增大一种反应物浓度使平衡向正反应方向移动,提高另一种物质的转化率;
C、从安全运输上看,硫酸厂靠近硫酸消费中心比靠近原料产地更为有利;
D、由于二氧化碳溶度积较小,应在NaCl饱和溶液中先通入的NH3再通入过量的过量CO2;
E、由于常压下三氧化硫的体积分数已达91%,若再加压对设备及电力系统要求高、成本高,使生产效益低;
(Ⅱ)(1)过碳酸钠(2Na2CO3?3H2O2)俗称固体双氧水,具有强氧化性;二氧化锰能够做催化剂,促进双氧水分解;硫化氢具有还原性,能够与固体双氧水反应;稀硫酸能够与碳酸钠反应;碳酸氢钠不与固体双氧水反应;
(2)根据饱和溶液中的溶解平衡进行分析;
(3)铁离子能够做催化剂,促进双氧水的分解;
(4)双氧水不稳定,温度高了容易分解;若是温度低了,反应速率太慢;生成流程中还需要洗涤操作;
(5)溴化氢被消耗的物质的量分为两部分,一部分是生成二氧化碳消耗的,另一部分是与双氧水反应了氧化还原反应消耗,计算出溴化氢的物质的量,就可以计算出溴化氢的物质的量浓度.
B、增大一种反应物浓度使平衡向正反应方向移动,提高另一种物质的转化率;
C、从安全运输上看,硫酸厂靠近硫酸消费中心比靠近原料产地更为有利;
D、由于二氧化碳溶度积较小,应在NaCl饱和溶液中先通入的NH3再通入过量的过量CO2;
E、由于常压下三氧化硫的体积分数已达91%,若再加压对设备及电力系统要求高、成本高,使生产效益低;
(Ⅱ)(1)过碳酸钠(2Na2CO3?3H2O2)俗称固体双氧水,具有强氧化性;二氧化锰能够做催化剂,促进双氧水分解;硫化氢具有还原性,能够与固体双氧水反应;稀硫酸能够与碳酸钠反应;碳酸氢钠不与固体双氧水反应;
(2)根据饱和溶液中的溶解平衡进行分析;
(3)铁离子能够做催化剂,促进双氧水的分解;
(4)双氧水不稳定,温度高了容易分解;若是温度低了,反应速率太慢;生成流程中还需要洗涤操作;
(5)溴化氢被消耗的物质的量分为两部分,一部分是生成二氧化碳消耗的,另一部分是与双氧水反应了氧化还原反应消耗,计算出溴化氢的物质的量,就可以计算出溴化氢的物质的量浓度.
解答:解:(I)A、氯化铝是共价化合物,所以熔融时,它是不导电的,所以只能去电解氧化铝,故A错误
B、增大一种反应物浓度使平衡向正反应方向移动,提高另一种物质的转化率,所以适当提高合成氨原料气中N2的含量,使平衡向正反应方向移动,可提高H2的转化率,故B正确;
C、从安全运输上看,硫酸厂靠近硫酸消费中心比靠近原料产地更为有利,故C正确;
D、由于二氧化碳溶度积较小,应在NaCl饱和溶液中先通入的NH3再通入过量的过量CO2,故D错误;
E、常压下三氧化硫的体积分数已达91%,二氧化硫转化率已经很高,若再加压对设备及电力系统要求高、成本高,使生产效益低,故E错误;
故答案为:ADE;
(II)(1)由于过碳酸钠(2Na2CO3?3H2O2)俗称固体双氧水,具有碳酸钠和双氧水的双重性质,
A、二氧化锰能够做催化剂,促进双氧水分解,使固体双氧水失效,故A正确;
B、硫化氢具有还原性,能够与固体双氧水反应,使固体双氧水失效,故B正确;
C、稀硫酸能够与碳酸钠反应,使固体双氧水失效,故C正确;
D、碳酸氢钠与固体双氧水不反应,不会使固体双氧水失效,故D错误;
所以正确的有ABC,
故答案为:强氧化性; ABC;
(2)加入了氯化钠,溶液中钠离子浓度增大,降低了固体双氧水的溶解度,会析出更多晶体,
故答案为:降低2Na2CO3?3H2O2溶解度,析出更多晶体;
(3)铁离子能够做催化剂,促进双氧水的分解,反应方程式为:2H2O2
2H2O+O2↑,
故答案为:催化双氧水的分解;2H2O2
2H2O+O2↑;
(4)由于双氧水不稳定,温度高了容易分解;若是温度低了,反应速率太慢;生成流程中还需要洗涤操作,
故答案为:温度高时双氧水易分解; 温度低时反应慢;洗涤;
(5)二氧化碳的物质的量为:
=0.02mol,
根据关系式:Na2CO3~CO2~2HBr,
生成二氧化碳消耗的溴化氢:n(HBr)=2×n(CO2)=0.04mol,
碳酸钠的物质的量为0.02mol,根据化学式2Na2CO3?3H2O2含有双氧水物质的量为:0.03mol,
根据反应H2O2+2HBr=Br2+2H2O,双氧水氧化的溴化氢物质的量为:0.03×2=0.06mol,
溴化氢总的物质的量为:0.04mol+0.06mol=0.1mol,
溴化氢的浓度为:
=1mol/L,
故答案为:1.
B、增大一种反应物浓度使平衡向正反应方向移动,提高另一种物质的转化率,所以适当提高合成氨原料气中N2的含量,使平衡向正反应方向移动,可提高H2的转化率,故B正确;
C、从安全运输上看,硫酸厂靠近硫酸消费中心比靠近原料产地更为有利,故C正确;
D、由于二氧化碳溶度积较小,应在NaCl饱和溶液中先通入的NH3再通入过量的过量CO2,故D错误;
E、常压下三氧化硫的体积分数已达91%,二氧化硫转化率已经很高,若再加压对设备及电力系统要求高、成本高,使生产效益低,故E错误;
故答案为:ADE;
(II)(1)由于过碳酸钠(2Na2CO3?3H2O2)俗称固体双氧水,具有碳酸钠和双氧水的双重性质,
A、二氧化锰能够做催化剂,促进双氧水分解,使固体双氧水失效,故A正确;
B、硫化氢具有还原性,能够与固体双氧水反应,使固体双氧水失效,故B正确;
C、稀硫酸能够与碳酸钠反应,使固体双氧水失效,故C正确;
D、碳酸氢钠与固体双氧水不反应,不会使固体双氧水失效,故D错误;
所以正确的有ABC,
故答案为:强氧化性; ABC;
(2)加入了氯化钠,溶液中钠离子浓度增大,降低了固体双氧水的溶解度,会析出更多晶体,
故答案为:降低2Na2CO3?3H2O2溶解度,析出更多晶体;
(3)铁离子能够做催化剂,促进双氧水的分解,反应方程式为:2H2O2
| ||
故答案为:催化双氧水的分解;2H2O2
| ||
(4)由于双氧水不稳定,温度高了容易分解;若是温度低了,反应速率太慢;生成流程中还需要洗涤操作,
故答案为:温度高时双氧水易分解; 温度低时反应慢;洗涤;
(5)二氧化碳的物质的量为:
| 0.448L |
| 22.4L/mol |
根据关系式:Na2CO3~CO2~2HBr,
生成二氧化碳消耗的溴化氢:n(HBr)=2×n(CO2)=0.04mol,
碳酸钠的物质的量为0.02mol,根据化学式2Na2CO3?3H2O2含有双氧水物质的量为:0.03mol,
根据反应H2O2+2HBr=Br2+2H2O,双氧水氧化的溴化氢物质的量为:0.03×2=0.06mol,
溴化氢总的物质的量为:0.04mol+0.06mol=0.1mol,
溴化氢的浓度为:
| 0.1mol |
| 0.1L |
故答案为:1.
点评:本题考查了固体双氧水过碳酸钠(2Na2CO3?3H2O2)的制取方法,涉及内容较多,充分考查了学生的综合能力,本题难度稍大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
(20分)
(I)多项选择题(6分)
下列说法中正确的是 。
| A.丙烯分子中有8个σ键,1个π键 |
| B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键 |
| C.NF3的沸点比NH3的沸点低得多,是因为NH3分子间有氢键,NF3只有范德华力 |
| D.NCl3和BC13分子中,中心原子都采用sp3杂化 |

(II)(14分)
人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测是钛(Ti),它被誉为“未来世纪的金属”。试回答下列问题:
(1)Ti元素在元素周期表中的位置是第________周期第________族;其基态原子的电子排布式为________。
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图所示,它的化学式是 ,其中Ti4+的氧配位数为 ,Ba2+的氧配位数为 ,

(3)常温下的TiCl4是有刺激性臭味的无
 色透明液体,熔点-23.2℃,沸点136.2℃,所以TiCl4应是 化合物,其固体是 晶体。TiCl4在潮湿空气中易挥发,水解而冒白烟,这是因为水解后有 生成。
色透明液体,熔点-23.2℃,沸点136.2℃,所以TiCl4应是 化合物,其固体是 晶体。TiCl4在潮湿空气中易挥发,水解而冒白烟,这是因为水解后有 生成。(4)已知Ti3+可形成配位数为6的配合物,其空间构型为正八面体,如下图1所示,我们通常可以用下图2所示的方法来表示其空间构型(其中A表示配体,M表示中心原子)。配位化合物[Co(NH3)4Cl2]的空间构型也为八面体型,它有 种同分异构体,请在下图方框中将其画出。

(20分)
(I)多项选择题(6分)
下列关于水处理的说法正确的是 。
| A.FeSO4·7H2O是常用的混凝剂,它除去悬浮固体颗粒的过程只是物理过程 |
| B.用纯碱和生石灰处理硬水,既可以除去暂时硬度,也可以除去永久硬度 |
| C.永久硬度的水可以采用离子交换法进行软化,其主要就是利用了离子交换膜技术 |
| D.污水处理中的三级处理是采用化学方法,对污水进行深度处理和净化 |
 渗析法是一种常用的海水淡化的方法,使用到的离子交换膜只有阳离子交换膜
渗析法是一种常用的海水淡化的方法,使用到的离子交换膜只有阳离子交换膜(II)(14分)
下列是工业合成氨的简要流程示意图:
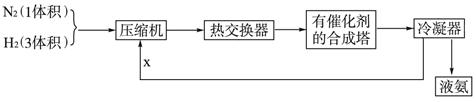
请回答下列问题:
(1)H2通常用碳氢化合物与水反应,写出有关的反应方程式 ,从冷凝器回流到压缩机中的X是 。
(2)比较工业上合成氨和SO2的催化氧化反应,其生产条件有哪些异同,并解释原因
。
(3)将N2、H2按体积比1∶3进入合成塔,从合成塔出来的混合气中,氨的体积分数为15%,则H2的体积分数为______________。
(4)NH3的用途之一是制造化肥,但在化肥的使用过程中要注意铵态氮肥不可以和草木灰混用,解释其原因 。
(5)NH3是一种重要的化工原料,除了制造化肥之外,再列举出两种NH3的用途
。



