摘要: 若在NaClO3浓溶液中加入固体KCl, 则可得到重要化工产品KClO3晶体. 下述有关生产原理正确的是 [ ] A. 变化的化学方程式是: NaClO3+KClKClO3+NaCl B. KClO3是难溶物 C. KClO3是比NaClO3更弱的电解质 D. 相同温度下, KClO3的溶解度比NaClO3小.
网址:http://m.1010jiajiao.com/timu3_id_349704[举报]
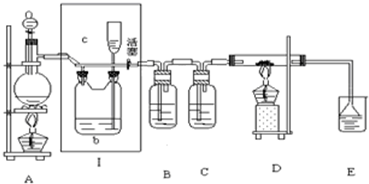
如图所示,是一个制取氯气并以氯气为原料进行特定反应的装置,其中各试剂瓶装的试剂为:B(碘化钾淀粉溶液),C(水),E(紫色石蕊试液).
(1)A是氯气发生装置,蒸馏烧瓶中盛放MnO2固体,分液漏斗中盛放浓盐酸,实验开始时,先点燃A处酒精灯,打开分液漏斗旋塞和Ⅰ处活塞,让氯气充满整个装置,再点燃D处酒精灯.请回答以下问题:
①怎样证明氯气已经充满了整个装置
②B中的实验现象是
(2)在D装置的硬质玻璃管内盛有碳粉,发生氧化还原反应,一种产物能使E处紫色石蕊试液变红,另一产物能使澄清石灰水变浑浊,根据信息写出D中反应的化学方程式
(3)在E处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是
(4)D处反应完毕后关闭分液漏斗旋塞,移去酒精灯,但由于余热的作用,A处仍有氯气产生,此时应该怎样操作
(5)若将C中的水换成氢氧化钠溶液,溶液中不但有NaClO还有NaClO3,其物质的量比为2:1,则参加反应的氧化剂和还原剂的物质的量比为:
查看习题详情和答案>>
(1)A是氯气发生装置,蒸馏烧瓶中盛放MnO2固体,分液漏斗中盛放浓盐酸,实验开始时,先点燃A处酒精灯,打开分液漏斗旋塞和Ⅰ处活塞,让氯气充满整个装置,再点燃D处酒精灯.请回答以下问题:
①怎样证明氯气已经充满了整个装置
观察当整个装置内充满黄绿色气体时,说明氯气已充满整个装置
观察当整个装置内充满黄绿色气体时,说明氯气已充满整个装置
;②B中的实验现象是
溶液变蓝
溶液变蓝
.(2)在D装置的硬质玻璃管内盛有碳粉,发生氧化还原反应,一种产物能使E处紫色石蕊试液变红,另一产物能使澄清石灰水变浑浊,根据信息写出D中反应的化学方程式
C+2H2O+2Cl2
CO2↑+4HCl↑
| ||
C+2H2O+2Cl2
CO2↑+4HCl↑
.
| ||
(3)在E处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是
生成的HCl使紫色石蕊试液变红色,剩余的氯气又与水作用生成次氯酸,又起漂白作用,使红色褪去
生成的HCl使紫色石蕊试液变红色,剩余的氯气又与水作用生成次氯酸,又起漂白作用,使红色褪去
.(4)D处反应完毕后关闭分液漏斗旋塞,移去酒精灯,但由于余热的作用,A处仍有氯气产生,此时应该怎样操作
关闭Ⅰ处活塞
关闭Ⅰ处活塞
;装置Ⅰ中的现象是Ⅰ处b瓶内液面下降,c中液面上升
Ⅰ处b瓶内液面下降,c中液面上升
.(5)若将C中的水换成氢氧化钠溶液,溶液中不但有NaClO还有NaClO3,其物质的量比为2:1,则参加反应的氧化剂和还原剂的物质的量比为:
7:3
7:3
.
如图是中学化学实验中常见的制备气体并进行某些物质的检验和性质实验的装置,A是制备气体的装置,C、D、E、F中盛装的液体可能相同,也可能不同.试回答:
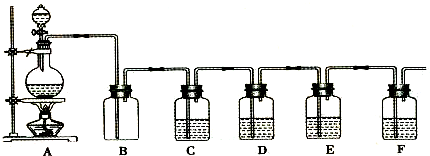
(1)如果A中的固体物质是碳,分液漏斗中盛装的是浓硫酸,试写出发生的化学反应方程式: ,若要检验生成的产物,则B、C、D、E、F中应分别加入的试剂为 、 、 、 、 ,E中试剂和C中相同,E中试剂所起的作用 ,B装置除可检出某产物外,还可起到 作用.
(2)若进行上述实验时在F中得到10.0g固体,则A中发生反应转移的电子数为 个.
(3)若A中是NaClO3和NaCl的混合物,分液漏斗中装有浓硫酸,B是空瓶.如果要比较Cl2、Br2的氧化性,验证潮湿Cl2的漂白性,则C、D、E、F中的试剂分别是 、 、 、 ,F中的试剂所起的作用是 .
查看习题详情和答案>>

(1)如果A中的固体物质是碳,分液漏斗中盛装的是浓硫酸,试写出发生的化学反应方程式:
(2)若进行上述实验时在F中得到10.0g固体,则A中发生反应转移的电子数为
(3)若A中是NaClO3和NaCl的混合物,分液漏斗中装有浓硫酸,B是空瓶.如果要比较Cl2、Br2的氧化性,验证潮湿Cl2的漂白性,则C、D、E、F中的试剂分别是
聚合硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理.现用一定质量的铁的氧化物(如下图)为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+.实验步骤如下:
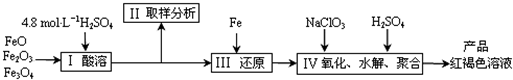
(1)实验室用18.4mol?L-1的浓硫酸配制250mL4.8mol?L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种带有刻度的移液管)外,还需
(2)步骤Ⅱ取样分析溶液中的Fe2+、Fe3+的含量,目的是
A.控制溶液中Fe2+与Fe3+含量比 B.确定下一步还原所需铁的量
C.确定氧化Fe2+所需NaClO3的量 D.确保铁的氧化物酸溶完全
(3)写出步骤Ⅳ中用NaClO3氧化时的离子方程式
已知1mol HNO3的价格为0.16元,1mol NaClO3的价格为0.45元,评价用HNO3代替NaClO3作为氧化剂的利弊,利是
(4)为了分析产品聚合硫酸铁溶液中SO42-与Fe3+物质的量之比,有人设计了以下操作:
(a)取25mL聚合硫酸铁溶液,加入足量的BaCl2溶液,产生白色沉淀,白色沉淀经过过滤、洗涤、干燥后,称重,其质量为m g.
(b)另取25mL聚合硫酸铁溶液,加足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250mL溶液,取该溶液25.00mL,用KMnO4酸性溶液滴定,到达终点时用去0.1000mol/L KMnO4标准溶液VmL.反应的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
回答下列问题:
①判断(a)步骤溶液中SO42-离子已沉淀完全的方法是
②在(b)步骤中判断达到终点的现象是
③聚合硫酸铁中SO42-与Fe3+的物质的量之比为
=
=
(用含m、V的代数式表示).
查看习题详情和答案>>

(1)实验室用18.4mol?L-1的浓硫酸配制250mL4.8mol?L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种带有刻度的移液管)外,还需
250mL容量瓶、胶头滴管
250mL容量瓶、胶头滴管
.(2)步骤Ⅱ取样分析溶液中的Fe2+、Fe3+的含量,目的是
BC
BC
.A.控制溶液中Fe2+与Fe3+含量比 B.确定下一步还原所需铁的量
C.确定氧化Fe2+所需NaClO3的量 D.确保铁的氧化物酸溶完全
(3)写出步骤Ⅳ中用NaClO3氧化时的离子方程式
6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
(提示:ClO3-转化为Cl-);已知1mol HNO3的价格为0.16元,1mol NaClO3的价格为0.45元,评价用HNO3代替NaClO3作为氧化剂的利弊,利是
原料成本较低
原料成本较低
,弊是产生气体对大气有污染
产生气体对大气有污染
.(4)为了分析产品聚合硫酸铁溶液中SO42-与Fe3+物质的量之比,有人设计了以下操作:
(a)取25mL聚合硫酸铁溶液,加入足量的BaCl2溶液,产生白色沉淀,白色沉淀经过过滤、洗涤、干燥后,称重,其质量为m g.
(b)另取25mL聚合硫酸铁溶液,加足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250mL溶液,取该溶液25.00mL,用KMnO4酸性溶液滴定,到达终点时用去0.1000mol/L KMnO4标准溶液VmL.反应的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
回答下列问题:
①判断(a)步骤溶液中SO42-离子已沉淀完全的方法是
取上层清夜,滴加BaCl2溶液,若无沉淀产生,则溶液中SO42-已沉淀完全
取上层清夜,滴加BaCl2溶液,若无沉淀产生,则溶液中SO42-已沉淀完全
;②在(b)步骤中判断达到终点的现象是
溶液由浅蓝色变为浅紫红色,且半分钟内不变色
溶液由浅蓝色变为浅紫红色,且半分钟内不变色
;③聚合硫酸铁中SO42-与Fe3+的物质的量之比为
| m |
| 233 |
| V |
| 200 |
| m |
| 233 |
| V |
| 200 |
用氯水对饮用水进行消毒已有百年的历史,这种消毒方法会使饮用水中有机物发生氯代,生成对人体有害的含氯有机物.世界环保联盟将全面禁止使用氯气对饮用水的消毒,建议使用广谱高效消毒剂二氧化氯.目前欧洲许多国家用氧化浓盐酸来制取ClO2:2NaClO3+4HCl(浓)=Cl2↑+2ClO2↑+2NaCl+2H2O.已知ClO2在杀菌消费后全部转化为Cl-,若将该方法生成的气体全部通入到600mL 0.500mol?L-1的KI溶液中,KI恰好全部氧化为I2,试求参加反应原NaClO3的质量.
查看习题详情和答案>>
氯气在生产生活中应用广泛.实验室可用MnO2与浓盐酸反应制取,反应原理如下:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
(1)若制得标准状况下11.2L Cl2,则被氧化的HCl为 mol.
(2)多余的氯气可用NaOH溶液吸收,反应的离子方程式为 .
(3)海底蕴藏着丰富的锰结核矿,其主要成分是MnO2.1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制备纯净的MnO2,其制备过程如图所示:
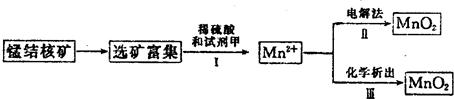
①步骤Ⅰ中,试剂甲必须具有的性质是 (填序号).
a.氧化性 b.还原性 c.酸性
②步骤Ⅲ中,以NaClO3为氧化剂,当生成0.050mol MnO2时,消耗0.10mol?L-1的NaClO3溶液200mL,该反应的离子方程式为 .
(4)用100mL12.0mol?L-1的浓盐酸与足量MnO2混合后,加热,反应产生的氯气物质的量远远少于0.30mol,请你分析可能的原因为 .
查看习题详情和答案>>
| ||
(1)若制得标准状况下11.2L Cl2,则被氧化的HCl为
(2)多余的氯气可用NaOH溶液吸收,反应的离子方程式为
(3)海底蕴藏着丰富的锰结核矿,其主要成分是MnO2.1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制备纯净的MnO2,其制备过程如图所示:

①步骤Ⅰ中,试剂甲必须具有的性质是
a.氧化性 b.还原性 c.酸性
②步骤Ⅲ中,以NaClO3为氧化剂,当生成0.050mol MnO2时,消耗0.10mol?L-1的NaClO3溶液200mL,该反应的离子方程式为
(4)用100mL12.0mol?L-1的浓盐酸与足量MnO2混合后,加热,反应产生的氯气物质的量远远少于0.30mol,请你分析可能的原因为