��Ŀ����
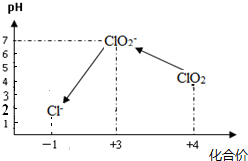
����ˮ������ˮ�����������а������ʷ����������������ʹ����ˮ���л�����ȴ������ɶ������к��ĺ����л�����绷�����˽�ȫ���ֹʹ������������ˮ������������ʹ�ù���Ч�������������ȣ�Ŀǰŷ���������������Ũ��������ȡClO2��2NaClO3+4HCl��Ũ��=Cl2��+2ClO2��+2NaCl+2H2O����֪ClO2��ɱ�����Ѻ�ȫ��ת��ΪCl-�������÷������ɵ�����ȫ��ͨ�뵽600mL 0.500mol?L-1��KI��Һ�У�KIǡ��ȫ������ΪI2������μӷ�ӦԭNaClO3��������
�������ɷ���ʽ��֪���ɵ�ΪCl2��ClO2�����ݵ���ת���غ����Cl2��ClO2�����ʵ������ٸ��ݷ���ʽ����NaClO3�����ʵ���������m=nM����NaClO3��������
����⣺�Ӧ����Cl2�����ʵ���Ϊnmol����ClO2�����ʵ���Ϊ2nmol���ɵ���ת���غ㣺2nmol+2nmol��[4-��-1��]=0.6L��0.500mol?L-1��
��ã�n=0.025��
���ݷ���ʽ��֪�μӷ�ӦNaClO3�����ʵ���=2��0.025mol=0.05mol��
�ʲμӷ�Ӧ��NaClO3������=0.05mol��106.5g/mol=5.325g��
�𣺲μӷ�ӦԭNaClO3������Ϊ5.325g��
��ã�n=0.025��
���ݷ���ʽ��֪�μӷ�ӦNaClO3�����ʵ���=2��0.025mol=0.05mol��
�ʲμӷ�Ӧ��NaClO3������=0.05mol��106.5g/mol=5.325g��
�𣺲μӷ�ӦԭNaClO3������Ϊ5.325g��
���������⿼��ṹ����ʽ�ļ��㡢������ԭ��Ӧ���㣬�Ƚϻ�����ע�����õ���ת���غ������������ʵ�����

��ϰ��ϵ�д�
�����Ŀ