题目内容
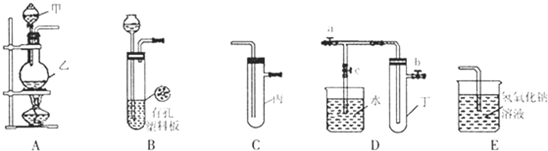
如图是中学化学实验中常见的制备气体并进行某些物质的检验和性质实验的装置,A是制备气体的装置,C、D、E、F中盛装的液体可能相同,也可能不同.试回答:
(1)如果A中的固体物质是碳,分液漏斗中盛装的是浓硫酸,试写出发生的化学反应方程式:
(2)若进行上述实验时在F中得到10.0g固体,则A中发生反应转移的电子数为
(3)若A中是NaClO3和NaCl的混合物,分液漏斗中装有浓硫酸,B是空瓶.如果要比较Cl2、Br2的氧化性,验证潮湿Cl2的漂白性,则C、D、E、F中的试剂分别是
分析:(1)浓硫酸和木炭粉在加热条件下发生反应生成二氧化碳、二氧化硫和水;
检验水用无水硫酸铜,检验二氧化硫使用品红溶液,检验二氧化碳用澄清石灰水,为了防止二氧化硫对二氧化碳的检验产生干扰要用足量的酸性KMnO4溶液吸收剩余的二氧化硫;B装置能盛放倒吸的液体;
(2)根据原子守恒计算,求出参加反应的CO2的量,再求出转移的电子的量;
(3)通过Cl2与Br2之间置换反应来判断二者的氧化性强弱关系,氯气为有毒气体最后要进行尾气处理.
检验水用无水硫酸铜,检验二氧化硫使用品红溶液,检验二氧化碳用澄清石灰水,为了防止二氧化硫对二氧化碳的检验产生干扰要用足量的酸性KMnO4溶液吸收剩余的二氧化硫;B装置能盛放倒吸的液体;
(2)根据原子守恒计算,求出参加反应的CO2的量,再求出转移的电子的量;
(3)通过Cl2与Br2之间置换反应来判断二者的氧化性强弱关系,氯气为有毒气体最后要进行尾气处理.
解答:解:(1)浓硫酸和木炭粉在加热条件下发生反应生成二氧化碳、二氧化硫和水,反应的化学方程式为C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O,
已知浓硫酸和木炭粉的反应产物为二氧化碳、二氧化硫和水,先用无水硫酸铜检验水的存在,以防后面的溶液对水的检验的干扰,再用品红溶液检验二氧化硫,然后用足量的酸性KMnO4溶液吸收二氧化硫,防止二氧化硫干扰二氧化碳的检验,在E中加入品红溶液来检验D中酸性KMnO4溶液是否把二氧化硫完全吸收,最后在F中加澄清石灰水来检验二氧化碳;
B装置能盛放倒吸的液体,防止液体倒吸进入反应装置,所以B还可起到防倒吸的作用,
故答案为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O;无水CuSO4;品红溶液; 足量的酸性KMnO4溶液; 品红溶液;澄清石灰水;检验SO2是否已被除尽;防倒吸;
(2)实验中发生的反应为C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O、Ca(OH)2+CO2=CaCO3↓+H2O,
已知进行上述实验时在F中得到10.0g固体,则n(CaCO3)=
=0.1mol,由方程式可知n(CO2)=n(CaCO3)=0.1mol,
当1molC转化为1molCO2时转移4mol电子,已知生成CO2为0.1mol,则转移的电子为0.4mol,即移的电子数为0.4×6.02×1023=2.408×1023;
故答案为:2.408×1023;
(3)A中是NaClO3和NaCl的混合物,分液漏斗中装有浓硫酸,B是空瓶;如果要比较Cl2、Br2的氧化性,则应该把生成的氯气通入饱和食盐水,除去氯气中杂质HCl;再通入品红溶液,若品红褪色说明潮湿Cl2有漂白性;把氯气通入NaBr溶液,有Br2生成,说明Cl2的氧化性比Br2强;因为氯气是有毒的气体能污染空气,所以最后在F试剂瓶中加氢氧化钠溶液来进行尾气处理,
故答案为:饱和食盐水;品红溶液;NaBr溶液;NaOH溶液;吸收尾气、防止污染空气.
| ||
已知浓硫酸和木炭粉的反应产物为二氧化碳、二氧化硫和水,先用无水硫酸铜检验水的存在,以防后面的溶液对水的检验的干扰,再用品红溶液检验二氧化硫,然后用足量的酸性KMnO4溶液吸收二氧化硫,防止二氧化硫干扰二氧化碳的检验,在E中加入品红溶液来检验D中酸性KMnO4溶液是否把二氧化硫完全吸收,最后在F中加澄清石灰水来检验二氧化碳;
B装置能盛放倒吸的液体,防止液体倒吸进入反应装置,所以B还可起到防倒吸的作用,
故答案为:C+2H2SO4(浓)
| ||
(2)实验中发生的反应为C+2H2SO4(浓)
| ||
已知进行上述实验时在F中得到10.0g固体,则n(CaCO3)=
| 10g |
| 100g/mol |
当1molC转化为1molCO2时转移4mol电子,已知生成CO2为0.1mol,则转移的电子为0.4mol,即移的电子数为0.4×6.02×1023=2.408×1023;
故答案为:2.408×1023;
(3)A中是NaClO3和NaCl的混合物,分液漏斗中装有浓硫酸,B是空瓶;如果要比较Cl2、Br2的氧化性,则应该把生成的氯气通入饱和食盐水,除去氯气中杂质HCl;再通入品红溶液,若品红褪色说明潮湿Cl2有漂白性;把氯气通入NaBr溶液,有Br2生成,说明Cl2的氧化性比Br2强;因为氯气是有毒的气体能污染空气,所以最后在F试剂瓶中加氢氧化钠溶液来进行尾气处理,
故答案为:饱和食盐水;品红溶液;NaBr溶液;NaOH溶液;吸收尾气、防止污染空气.
点评:本题考查了基本实验操作,包括气体的制备、除杂、检验、尾气处理、防倒吸等,还涉及了氧化还原反应中转移电子数目的计算,考查的知识点较多,侧重于基础知识的考查,题目难度中等.

练习册系列答案
相关题目
27. 如图所示是中学化学实验中常见的装置,它有多种用途。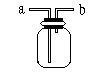
⑴若瓶中装有X溶液,将CO和CO2的混合气体由a管口通入,用以除去CO2,则X为________。
| A.H2SO4 | B.NaOH | C.NaCl | D.HCl |
⑶医院里给病人输氧时,往往在氧气钢瓶与病人呼吸面具之间安装有水的该装置,观察气泡产生的情况,以便调节供氧速率,此时氧气应从 管口导入。