摘要:已知在NaH2PO4溶液中存在着下列平衡体系:H2O H+ +OH-.H2PO4-+H2O H3PO4+OH-.H2PO4- H+ +HPO42-.HPO42- H+ +PO43---下列关系式正确的是( ) A.2[OH-] =[H+] B.[H2PO4-] +[HPO42-]+[PO43- ]+[H3PO4] =[Na+] C.[Na+] +[H+]=[OH- ]+[H2PO4-] +[HPO42-]+[PO43-] D.[Na+] +[H+]=[H2PO4- ]+[OH-] +2[HPO42-]+3[PO43-]
网址:http://m.1010jiajiao.com/timu3_id_347422[举报]
已知:Na2HPO4溶液PH值约为9,NaH2PO4溶液PH值约为6,又知:在Na2HPO4溶液中滴加AgNO3溶液时,有Ag3PO4黄色沉淀生成,溶液则由反应前的弱碱性转变为反应后的弱酸性.
(1)Na2HPO4溶液呈弱碱性的原因是
(2)在Na2HPO4溶液中加入少量AgNO3溶液产生Ag3PO4沉淀的离子方程式是
查看习题详情和答案>>
(1)Na2HPO4溶液呈弱碱性的原因是
HPO42-水解程度大于电离程度
HPO42-水解程度大于电离程度
,表示这一反应的离子方程式是HPO42-+H2O=H2PO4-+OH-
HPO42-+H2O=H2PO4-+OH-
(2)在Na2HPO4溶液中加入少量AgNO3溶液产生Ag3PO4沉淀的离子方程式是
2HPO42-+3Ag+=Ag3PO4↓+H2PO4-
2HPO42-+3Ag+=Ag3PO4↓+H2PO4-
.已知NaH2PO4溶液呈酸性,在水溶液中存在如下水解平衡:H2PO4-+H2O?H3PO4+OH-,现将0.1mol/L NaH2PO4溶液稀释后,增大的是( )
| A、c(H+) | B、c(OH-) | C、c(H2PO4-) | D、Kw |
磷矿石的主要成分是Ca5F(PO4)3,含少量MgO、Fe2O3等杂质.工业上以磷矿石为原料制备H3PO4的常用流程如下:
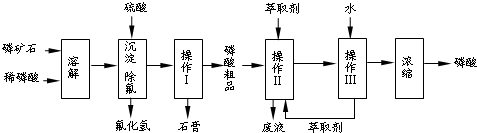
已知:Ca5F(PO4)3+7H3PO4→5Ca (H2PO4)2+HF
(1)采用这种方法在实验室溶解磷矿石 (填“能”或“不能”)用玻璃仪器,原因是 .
(2)操作Ⅰ的名称是 ,所得磷酸粗品中除含H+外,还含有的阳离子是 .
(3)在实验室中实现操作Ⅱ和Ⅲ所需要的玻璃仪器有 ,推测该萃取剂一定具有的性质是 .
a.该萃取剂与水互不相溶 b.相同条件下,该萃取剂的密度比水小
c.磷酸在该萃取剂中的溶解度很小 d.某些磷酸二氢盐在该萃取剂中的溶解度很小
(4)采用该流程除制取磷酸外,还有 等副产品产生,请说出其中一种副产品的用途 .
(5)与直接用硫酸溶解磷矿石的工艺相比,该工艺的优点是 .
(6)测定磷酸产品的浓度可采用滴定法.准确量取10.00mL磷酸产品(密度为1.526g/cm3)溶于水配成1L溶液;取溶解后的溶液20.00mL,以甲基橙作指示剂,用0.103mol/L 标准NaOH溶液滴定至终点(生成NaH2PO4),消耗NaOH溶液21.35mL.该磷酸产品的质量分数为 .
查看习题详情和答案>>

已知:Ca5F(PO4)3+7H3PO4→5Ca (H2PO4)2+HF
(1)采用这种方法在实验室溶解磷矿石
(2)操作Ⅰ的名称是
(3)在实验室中实现操作Ⅱ和Ⅲ所需要的玻璃仪器有
a.该萃取剂与水互不相溶 b.相同条件下,该萃取剂的密度比水小
c.磷酸在该萃取剂中的溶解度很小 d.某些磷酸二氢盐在该萃取剂中的溶解度很小
(4)采用该流程除制取磷酸外,还有
(5)与直接用硫酸溶解磷矿石的工艺相比,该工艺的优点是
(6)测定磷酸产品的浓度可采用滴定法.准确量取10.00mL磷酸产品(密度为1.526g/cm3)溶于水配成1L溶液;取溶解后的溶液20.00mL,以甲基橙作指示剂,用0.103mol/L 标准NaOH溶液滴定至终点(生成NaH2PO4),消耗NaOH溶液21.35mL.该磷酸产品的质量分数为
(15分)、对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。若25℃时有HA H++A―,则K=
H++A―,则K= 。式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25℃)。
。式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25℃)。
回答下列问题:
(1)当升高温度时,K值____(填“变大”“变小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系? ____ ________。
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、
H2PO4-、HPO42-都看做是酸,其中酸性最强的是_ ,最弱的是_ __。
(4)同一多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律是_____________,产生此规律的原因是_____________ ___。
(5) Na2CO3溶液呈_ _(填“酸性”“碱性”或“中性”),其原因(用离子方程式表示)是_ 。
(6)已知NaH2PO4溶液呈酸性,则该溶液中c(H3PO4)____c(HPO42-)(填“大于”或“小于” )。