摘要:(一)选择: 1.将下列金属分别放入冷的浓硝酸中.不能继续发生反应的是( ) A.镁 B.铝 C.铜 D.银 2.下列物质地中.只能由单质直接化合而制得的是( ) A.FeCl3 B.CuS C.Al2S3 D.FeS 3.自然界的镁.铝主要的存在形式是( ) A.游离态 B.化合态 C.合金 D.氧化态 4.下列不属于更水的是( ) A.矿泉水 B.地下水 C.蒸馏水 D.海水 5.主要成分的镁盐的物质是( ) A.冰晶石 B.重晶石 C.光卤石 D.明矾 6.欲从含少量Al3+的FeCl3溶液中除去Al3+.最好应加入的试剂是( ) A.NaOH溶液和盐酸 B. KOH溶液和稀H2SO4 C.氨水和盐酸 D.碳酸铵 7.为了除去MgCl2酸性溶液中的少量Fe3+.可在加热条件下加入一种试剂.过滤后.再加适量盐酸.这种试剂是( ) A.NH3·H2O B.NaOH C.Na2CO3 D.MgCO3 8.在一定量的偏铝酸钠溶液中.加入下列哪一种溶液可使获得的沉淀量最大( ) A.AlCl3 B.HCl C.CO2 D.NaHSO4 9.镁.铝都是较活泼的金属.下列描述正确的是( ) A.镁的硬度比铝稍大.熔沸点都比铝高 B.镁.铝都能跟稀盐酸.稀硫酸.强碱反应 C.镁在点燃条件下可以跟二氧化碳起反应.铝在一定条件下可以跟氧化铁发生氧化-还原反应 D.铝热剂是镁条.铝粉和氧化铁的混合物 10.在下列物质的水溶液中.加入稀H2SO4或AlCl3溶液时.都会有沉淀生成的是( ) A.BaCl2 B.Ba(OH)2 C.Na2CO3 D.NaAlO2 11.镁粉在焰火.闪光粉中是不可少的原料.工业制造镁粉是将镁蒸气在气体中冷却.下列可作为冷却气体的是( ) CO2 H2 (5)N2 A. C. 12.把等质量的金属镁分别放在空气中 (3)二氧化碳气体中.充分燃烧得到固体物质的总质量依次分别是W1.W2.W3.三者的大小关系是( ) A.无法判断 B.W1一定小于W3 C.W3一定大于W2 D.W1等于W3 13.将5克某金属加入100毫升4摩/升的硫酸溶液中.当硫酸浓度降到原浓度的一半时.金属还没有全部溶解.该金属可能是( ) A.铝 B.锌 C.铁 D.镁 14.现有Al(OH)3和Mg(OH)2的混合物.欲使Mg(OH)2溶解.Al(OH)3不溶解.可加入的物质是( ) A.(NH4)2SO4饱和溶液 B.NaOH溶液 C.盐酸 D.氨水 15.把0.1mol铝投入到100mL 3mol/L的NaOH溶液中充分反应后.再滴入1mol/L的H2SO4溶液120mL.其结果是( ) A.溶液的pH值<7 B.得到澄清透明溶液 C.沉淀未能完全溶解 D.先有白色沉淀生成.后逐渐溶解 16.向明矾溶液里滴入Ba(OH)2溶液.当SO42-沉淀完全时.铝元素的存在形式是( ) A.一部分为Al(OH)3沉淀.一部分以Al3+形式存在于溶液中 B.一部分为 Al(OH)3沉淀.一部分以AlO2-形式存在于溶液中 C.全部为Al(OH)3沉淀 D.几乎全部以AlO2-形式存在于溶液中 17.既能跟明矾溶液反应.又能跟适量NH4HSO4溶液反应生成白色沉淀的是( ) A. FeCl3溶液 B.NaHCO3溶液 C.KalO2溶液 D.Ba(OH)2溶液 18.冶金工业上常用电解熔融MgCl2而不用电解MgO的方法制取镁.其原因是( ) A.熔融的MgO不导电 B.MgO分子间作用力很大 C.MgO熔点高 D.MgO属原子晶体 19.将物质的量都为amol的Na和Al一同放入mg足量水中.所得溶液的密度为dg/cm3.则此溶液的物质的量浓度为( ) A.mol/L B. mol/L C.mol/L D.mol/L 20.现有20mLMgCl2和AlCl3的混合溶液.其中[Mg2+]=0.2mol/L.[Cl-]=1.3mol/L.要使Mg2+转化成Mg(OH)2并使Mg2+.Al3+分离开来.至少需要4mol/L NaOH溶液( ) A.140mL B.120mL C.100mL D.80mL
网址:http://m.1010jiajiao.com/timu3_id_347219[举报]
甲、乙是同主族非金属元素组成的单质,乙通常状况下是深红棕色液体.X、Y、Z是化合物.X溶液呈淡绿色,Y、Z的溶液都能使KSCN溶液变红.它们之间有如图1所示转化关系.
请回答:
(1)将Y的饱和溶液滴入沸水中,继续加热可得红褐色液体,此液体不具有的性质是
A.光束通过该液体时形成光亮的“通路”
B.插入电极通过直流电后,有一极附近液体颜色加深
C.向该液体中加入硝酸银溶液,无沉淀产生
D.将该液体加热蒸干、灼烧后,有氧化物生成
(2)①单质甲、乙和Y溶液中的阳离子氧化性由强到弱的顺序为:
②少量单质甲通入X溶液中发生的离子方程式为
(3)实验室制备、收集纯净干燥的甲单质,所需仪器如图2,装置A为发生装置;除装置A中所需的药品外,其他装置中供选择的药品有:浓硫酸、碱石灰、五氧化二磷、饱和食盐水、氢氧化钠溶液.
①装置A中发生反应的化学反应方程式:
②按气流的方向连接各仪器接口,顺序为a→
③指出装置B、C、E中的药品(从提供的药品中选择):
B:
查看习题详情和答案>>

请回答:
(1)将Y的饱和溶液滴入沸水中,继续加热可得红褐色液体,此液体不具有的性质是
C
C
A.光束通过该液体时形成光亮的“通路”
B.插入电极通过直流电后,有一极附近液体颜色加深
C.向该液体中加入硝酸银溶液,无沉淀产生
D.将该液体加热蒸干、灼烧后,有氧化物生成
(2)①单质甲、乙和Y溶液中的阳离子氧化性由强到弱的顺序为:
Cl2>Br2>Fe3+
Cl2>Br2>Fe3+
(用化学式表示)②少量单质甲通入X溶液中发生的离子方程式为
Cl2+2Fe2+=2Cl-+2Fe3+
Cl2+2Fe2+=2Cl-+2Fe3+
.(3)实验室制备、收集纯净干燥的甲单质,所需仪器如图2,装置A为发生装置;除装置A中所需的药品外,其他装置中供选择的药品有:浓硫酸、碱石灰、五氧化二磷、饱和食盐水、氢氧化钠溶液.
①装置A中发生反应的化学反应方程式:
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
.
| ||
②按气流的方向连接各仪器接口,顺序为a→
d
d
→e
e
→b或(c)
b或(c)
→c或(b)
c或(b)
→f.③指出装置B、C、E中的药品(从提供的药品中选择):
B:
五氧化二磷
五氧化二磷
C:饱和食盐水
饱和食盐水
E:氢氧化钠溶液
氢氧化钠溶液
.(2009?南京二模)选做题,本题有A、B两题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容,请选择其中一题作答,并把所选题目对应字母后的方框涂黑.若两题都作答,将按A题评分.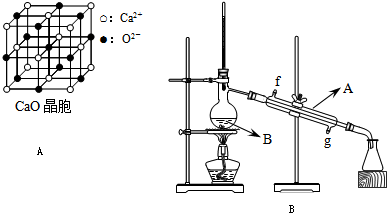
A.可以由下列反应合成三聚氰胺:
CaO+3C
CaC2+CO↑ CaC2+N2
CaCN2+C↑ CaCN2+2H2O=NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺.
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:
(2)尿素分子中C原子采取
 ,其中碳氧原子之间的共价键是
,其中碳氧原子之间的共价键是
A.2个σ键 B.2个π键 C.1个σ键、1个π键
(3)三聚氰胺(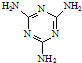 )俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸( 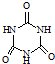 )后,三聚氰酸与三聚氰胺分子相互之间通过
)后,三聚氰酸与三聚氰胺分子相互之间通过
(4)CaO晶胞如图A所示,CaO晶体中Ca2+的配位数为
B.实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的物理性质如下表.请回答有关问题.
Ⅰ.乙酸正丁酯粗产品的制备
在干燥的50mL圆底烧瓶中,装入沸石,加入11.5mL正丁醇和9.4mL冰醋酸,再加3~4滴浓硫酸.然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管,加热冷凝回流反应.
(1)本实验过程中可能产生多种有机副产物,写出其中两种的结构简式:
(2)实验中为了提高乙酸正丁酯的产率,采取的措施是:
Ⅱ.乙酸正丁酯粗产品的制备
(1)将乙酸正丁酯粗产品用如下的操作进行精制:①水洗 ②蒸馏 ③用无水MgSO4干燥 ④用10%碳酸钠洗涤,正确的操作步骤是
A.①②③④B.③①④②C.①④①③②D.④①③②③
(2)将酯层采用如图B所示装置蒸馏.
1.出图中仪器A的名称
2.②蒸馏收集乙酸正丁酯产品时,应将温度控制在
Ⅲ.计算产率
测量分水器内由乙酸与正丁醇反应生成的水体积为1.8mL,假设在制取乙酸正丁酯过程中反应物和生成物没有损失,且忽略副反应,计算乙酸正丁酯的产率
查看习题详情和答案>>

A.可以由下列反应合成三聚氰胺:
CaO+3C
| ||
| ||
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:
1s22s22p63s23p63d104s2或[Ar]3d104s2
1s22s22p63s23p63d104s2或[Ar]3d104s2
.CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有N2O和CO2
CO2
(填化学式),由此可以推知CN22-离子的空间构型为直线形
直线形
.(2)尿素分子中C原子采取
sp2
sp2
杂化.尿素分子的结构简式是

C
C
(填字母)A.2个σ键 B.2个π键 C.1个σ键、1个π键
(3)三聚氰胺(
 )俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(  )后,三聚氰酸与三聚氰胺分子相互之间通过
)后,三聚氰酸与三聚氰胺分子相互之间通过分子间氢键
分子间氢键
结合,在肾脏内易形成结石.(4)CaO晶胞如图A所示,CaO晶体中Ca2+的配位数为
6
6
.CaO晶体和NaCl晶体的晶格能分别为:CaO 3401kJ/mol、NaCl 786kJ/mol.导致两者晶格能差异的主要原因是CaO晶体中Ca 2+、O 2-的带电量大于NaCl晶体中Na+、Cl-的带电量
CaO晶体中Ca 2+、O 2-的带电量大于NaCl晶体中Na+、Cl-的带电量
.B.实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的物理性质如下表.请回答有关问题.
| 化合物 | 密度/g?cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 0.810 | 118.0 | 9 |
| 冰醋酸 | 1.049 | 118.1 | ∞ |
| 乙酸正丁酯 | 0.882 | 126.1 | 0.7 |
在干燥的50mL圆底烧瓶中,装入沸石,加入11.5mL正丁醇和9.4mL冰醋酸,再加3~4滴浓硫酸.然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管,加热冷凝回流反应.
(1)本实验过程中可能产生多种有机副产物,写出其中两种的结构简式:
CH3CH2CH2CH2OCH2CH2CH2CH3
CH3CH2CH2CH2OCH2CH2CH2CH3
、CH2=CHCH2CH3
CH2=CHCH2CH3
.(2)实验中为了提高乙酸正丁酯的产率,采取的措施是:
用分水器及时移走反应生成的水,减少生成物的浓度;
用分水器及时移走反应生成的水,减少生成物的浓度;
、使用过量醋酸,提高正丁醇的转化率
使用过量醋酸,提高正丁醇的转化率
.Ⅱ.乙酸正丁酯粗产品的制备
(1)将乙酸正丁酯粗产品用如下的操作进行精制:①水洗 ②蒸馏 ③用无水MgSO4干燥 ④用10%碳酸钠洗涤,正确的操作步骤是
C
C
(填字母).A.①②③④B.③①④②C.①④①③②D.④①③②③
(2)将酯层采用如图B所示装置蒸馏.
1.出图中仪器A的名称
冷凝管
冷凝管
.冷却水从下
下
口进入(填字母).2.②蒸馏收集乙酸正丁酯产品时,应将温度控制在
126.1℃
126.1℃
左右.Ⅲ.计算产率
测量分水器内由乙酸与正丁醇反应生成的水体积为1.8mL,假设在制取乙酸正丁酯过程中反应物和生成物没有损失,且忽略副反应,计算乙酸正丁酯的产率
79.4%
79.4%
.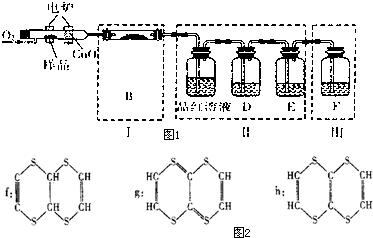 有机物M(分子式:C6H4S4)是隐形飞机上吸波材料的主要成分.某化学兴趣小组为验证其组成元素,并探究其分子结构进行了下列实验:
有机物M(分子式:C6H4S4)是隐形飞机上吸波材料的主要成分.某化学兴趣小组为验证其组成元素,并探究其分子结构进行了下列实验:(一)验证组成元素
将少量样品放入A的燃烧管中,通入足量O2,用电炉加热使其充分燃烧,并将燃烧产物依次通入余下装置.(夹持仪器的装置已略去)
(1)写出A中样品燃烧的化学方程式
(2)装置B的目的是验证有机物中含氢元素,则B中盛装的试剂可为
(3)D中盛放的试剂是
可供选择试剂:a.NaOH溶液 b.品红溶液 c.KMnO4溶液 d.饱和石灰水
(4)能证明有机物含碳元素的现象是
(5)装置Ⅰ、Ⅱ不能互换的理由是
(6)燃烧管中放入CuO的作用是
(7)指出装置F的错误
(二)探究有机物M的分子结构
(8)文献资料表明,该有机物M为二个六元环结构,有很高的对称性,氢原子的环境都相同.将2.04g该有机物加入溴的CCl4溶液,充分振荡后溶液褪色,并消耗了0.03molBr2
有机物M的结构简式为
为测定某有机化合物A的结构,进行如下实验.
[分子式的确定]
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4g H2O和8.8g CO2,消耗氧气6.72L(标准状况下).则该物质中各元素的原子个数比是
(2)质谱仪测定有机化合物的相对分子质量为46,则该物质的分子式是
(3)根据元素的化合价,预测A的可能结构并写出结构简式
[结构式的确定]
(4)经测定,有机物A分子内有3类氢原子,则A的结构简式为
[性质实验]
(5)A在铜的催化下,可被氧气氧化为B,反应方程式为:
B在加热的条件下与银氨溶液反应,反应方程式为:
(6)A在一定条件下脱水可生成C,C可聚合成包装塑料D,请写出C转化为D的化学反应方程式:
(7)体育比赛中当运动员肌肉扭伤时,队医随即用氯乙烷(沸点为12.27℃)对受伤部位进行局部冷冻麻醉.请用C选择合适的试剂和方法制备氯乙烷,要求原子利用率为100%,请写出制备反应方程式:
(8)A可通过粮食在一定条件下制得,由粮食制得的A在一定温度下密闭储存,因为发生一系列的化学变化而变得更醇香.请写出最后一步反应的化学方程式:
查看习题详情和答案>>
[分子式的确定]
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4g H2O和8.8g CO2,消耗氧气6.72L(标准状况下).则该物质中各元素的原子个数比是
n(C):n(H):n(O)=2:6:1
n(C):n(H):n(O)=2:6:1
;(2)质谱仪测定有机化合物的相对分子质量为46,则该物质的分子式是
C2H6O
C2H6O
;(3)根据元素的化合价,预测A的可能结构并写出结构简式
CH3CH2OH、CH3-O-CH3
CH3CH2OH、CH3-O-CH3
.[结构式的确定]
(4)经测定,有机物A分子内有3类氢原子,则A的结构简式为
CH3CH2OH
CH3CH2OH
.[性质实验]
(5)A在铜的催化下,可被氧气氧化为B,反应方程式为:
2CH3CH2OH+O2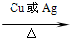 2CH3CHO+2H2O
2CH3CHO+2H2O
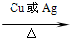 2CH3CHO+2H2O
2CH3CHO+2H2O2CH3CH2OH+O2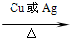 2CH3CHO+2H2O
2CH3CHO+2H2O
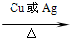 2CH3CHO+2H2O
2CH3CHO+2H2OB在加热的条件下与银氨溶液反应,反应方程式为:
CH3CHO+2Ag(NH3)2OH
2Ag↓+3NH3↑+H2O+CH3COONH4
| 水浴加热 |
CH3CHO+2Ag(NH3)2OH
2Ag↓+3NH3↑+H2O+CH3COONH4
| 水浴加热 |
(6)A在一定条件下脱水可生成C,C可聚合成包装塑料D,请写出C转化为D的化学反应方程式:
nCH2=CH2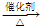
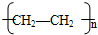 ,
,
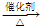
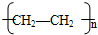 ,
,nCH2=CH2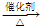
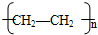 ,
,
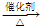
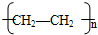 ,
,(7)体育比赛中当运动员肌肉扭伤时,队医随即用氯乙烷(沸点为12.27℃)对受伤部位进行局部冷冻麻醉.请用C选择合适的试剂和方法制备氯乙烷,要求原子利用率为100%,请写出制备反应方程式:
CH2=CH2+HCl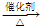 CH3CH2Cl,
CH3CH2Cl,
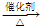 CH3CH2Cl,
CH3CH2Cl,CH2=CH2+HCl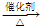 CH3CH2Cl,
CH3CH2Cl,
.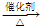 CH3CH2Cl,
CH3CH2Cl,(8)A可通过粮食在一定条件下制得,由粮食制得的A在一定温度下密闭储存,因为发生一系列的化学变化而变得更醇香.请写出最后一步反应的化学方程式:
CH3COOH+CH3CH2OH CH3COOC2H5+H2O,
CH3COOC2H5+H2O,
 CH3COOC2H5+H2O,
CH3COOC2H5+H2O,CH3COOH+CH3CH2OH CH3COOC2H5+H2O,
CH3COOC2H5+H2O,
. CH3COOC2H5+H2O,
CH3COOC2H5+H2O,以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工.
(1)将水蒸气通过红热的炭即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ?mol-1.
①该反应在常温下
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是
a.容器中的压强不变 b.1mol H-H键断裂的同时,断裂2mol H-O键
c.c(CO)=c(H2) d.密闭容器的容积不再改变
③若在一容积不变的密闭容器中,发生上述反应,充入N2,则平衡
若在一容积可变的密闭容器中,发生上述反应,充入N2,则平衡
(2)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①实验1中以v(CO2)表示的反应速率为
②该反应为
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0.在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列条件能使上述反应的反应速率增大,且平衡向正反应方向移动的是
a.及时分离出CH3OH气体
b.适当升高温度
c.保持容器的容积不变,再充入1mol CO2和3mol H2
d.选择高效的催化剂.
查看习题详情和答案>>
(1)将水蒸气通过红热的炭即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ?mol-1.
①该反应在常温下
不能
不能
自发进行(填“能”或“不能”);②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是
bd
bd
(填字母,下同).a.容器中的压强不变 b.1mol H-H键断裂的同时,断裂2mol H-O键
c.c(CO)=c(H2) d.密闭容器的容积不再改变
③若在一容积不变的密闭容器中,发生上述反应,充入N2,则平衡
不
不
(填“正向”、“逆向”或“不”)移动.若在一容积可变的密闭容器中,发生上述反应,充入N2,则平衡
正向
正向
(填“正向”、“逆向”或“不”)移动.(2)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 6 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
0.13mol/(L.min)
0.13mol/(L.min)
(取小数点后两位);②该反应为
放热
放热
(填“吸热”或“放热”)反应,实验2的化学平衡常数K=0.17
0.17
(取两位有效数字)(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0.在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列条件能使上述反应的反应速率增大,且平衡向正反应方向移动的是
c
c
(填写序号字母).a.及时分离出CH3OH气体
b.适当升高温度
c.保持容器的容积不变,再充入1mol CO2和3mol H2
d.选择高效的催化剂.