题目内容
以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工.
(1)将水蒸气通过红热的炭即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ?mol-1.
①该反应在常温下
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是
a.容器中的压强不变 b.1mol H-H键断裂的同时,断裂2mol H-O键
c.c(CO)=c(H2) d.密闭容器的容积不再改变
③若在一容积不变的密闭容器中,发生上述反应,充入N2,则平衡
若在一容积可变的密闭容器中,发生上述反应,充入N2,则平衡
(2)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①实验1中以v(CO2)表示的反应速率为
②该反应为
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0.在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列条件能使上述反应的反应速率增大,且平衡向正反应方向移动的是
a.及时分离出CH3OH气体
b.适当升高温度
c.保持容器的容积不变,再充入1mol CO2和3mol H2
d.选择高效的催化剂.
(1)将水蒸气通过红热的炭即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ?mol-1.
①该反应在常温下
不能
不能
自发进行(填“能”或“不能”);②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是
bd
bd
(填字母,下同).a.容器中的压强不变 b.1mol H-H键断裂的同时,断裂2mol H-O键
c.c(CO)=c(H2) d.密闭容器的容积不再改变
③若在一容积不变的密闭容器中,发生上述反应,充入N2,则平衡
不
不
(填“正向”、“逆向”或“不”)移动.若在一容积可变的密闭容器中,发生上述反应,充入N2,则平衡
正向
正向
(填“正向”、“逆向”或“不”)移动.(2)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 6 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
0.13mol/(L.min)
0.13mol/(L.min)
(取小数点后两位);②该反应为
放热
放热
(填“吸热”或“放热”)反应,实验2的化学平衡常数K=0.17
0.17
(取两位有效数字)(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0.在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列条件能使上述反应的反应速率增大,且平衡向正反应方向移动的是
c
c
(填写序号字母).a.及时分离出CH3OH气体
b.适当升高温度
c.保持容器的容积不变,再充入1mol CO2和3mol H2
d.选择高效的催化剂.
分析:(1)①该反应为熵增大,焓增大的反应,由△G=△H-T△S判断;
②根据根据化学平衡状态的特征进行判断;
③根据容积不变,充入氮气对各组分的浓度的不变进行判断;容积可变,充入氮气,体系内压强不变,容器的容积变大,相当于减压;
(2)①根据v=
计算反应速率;
②根据温度变化,平衡时的生成物的物质的量的多少判断平衡移动的方向;根据平衡常数表达式计算出实验2的平衡常数;
(3)根据影响化学反应速率的因素及平衡移动原理进行判断.
②根据根据化学平衡状态的特征进行判断;
③根据容积不变,充入氮气对各组分的浓度的不变进行判断;容积可变,充入氮气,体系内压强不变,容器的容积变大,相当于减压;
(2)①根据v=
| △c |
| △t |
②根据温度变化,平衡时的生成物的物质的量的多少判断平衡移动的方向;根据平衡常数表达式计算出实验2的平衡常数;
(3)根据影响化学反应速率的因素及平衡移动原理进行判断.
解答:解:(1)①该反应为熵增大,焓增大的反应,由△G=△H-T△S,△G<0反应可自发进行,可知该反应在高温时可以自发进行,常温下难以自发进行,
故答案为:不能;
②a.容器中的压强不变,由于容积可变,所以压强始终不是变量,无法根据压强判断是否达到平衡状态,故a错误;
b.1mol H-H键断裂,会生成2mol氢氧建,同时断裂2mol H-O键,说明正逆反应速率相等,达到了平衡状态,故b正确;
c.c(CO)=c(H2),无法判断各组分的浓度是否不变,无法判断是否达到了平衡状态,故c错误;
d.密闭容器的容积不再改变,说明各组分的物质的量不在变化,达到了平衡状态,故d正确;
故选bd;
③由于容积不变,充入氮气后,各组分的浓度没有变化,所以平衡不移动;容积可变,容器内压强不变,充入氮气,容器的容积变大,各组分的浓度减小,相当于压强减小,则平衡向着正向移动,
故答案为:不;正向;
(2)①v(CO2)=v(CO)=
=0.13 mol/(L.min),故答案为:0.13 mol/(L.min);
②根据CO(g)+H2O(g)?CO2(g)+H2(g)可知压强对平衡移动无影响,如果在650℃,H2O、CO的物质的量改为1mol、2mol,达到平衡时CO的物质的量应为1.2mol,而900℃时CO的物质的量应为1.6mol,说明升高温度平衡向逆反应方向移动,则正反应为放热反应;实验2中达到平衡时,c(CO2)=c(H2)=
=0.2mol/L,
c(CO)=
=0.8mol/L,c(H2O)=
=0.3mol/L,K=
≈0.17,
故答案为:放热;0.17;
(3)a、及时分离出CH3OH气体,平衡向着向着移动,但是甲醇浓度减小,反应速率减小,故a错误;
b、升高温度反应速率增大,但是平衡向逆反应方向移动,故a错误;
b.充入He(g),使体系压强增大,但平衡没有移动,故b错误;
c.保持容器的容积不变,再充入1mol CO2和3mol H2,压强增大,反应速率增大,且平衡向着正向移动,故c正确;
d.选择高效的催化剂,催化剂只影响化学反应速率,不影响平衡移动,故d错误;
故答案为:c.
故答案为:不能;
②a.容器中的压强不变,由于容积可变,所以压强始终不是变量,无法根据压强判断是否达到平衡状态,故a错误;
b.1mol H-H键断裂,会生成2mol氢氧建,同时断裂2mol H-O键,说明正逆反应速率相等,达到了平衡状态,故b正确;
c.c(CO)=c(H2),无法判断各组分的浓度是否不变,无法判断是否达到了平衡状态,故c错误;
d.密闭容器的容积不再改变,说明各组分的物质的量不在变化,达到了平衡状态,故d正确;
故选bd;
③由于容积不变,充入氮气后,各组分的浓度没有变化,所以平衡不移动;容积可变,容器内压强不变,充入氮气,容器的容积变大,各组分的浓度减小,相当于压强减小,则平衡向着正向移动,
故答案为:不;正向;
(2)①v(CO2)=v(CO)=
| ||
| 6min |
②根据CO(g)+H2O(g)?CO2(g)+H2(g)可知压强对平衡移动无影响,如果在650℃,H2O、CO的物质的量改为1mol、2mol,达到平衡时CO的物质的量应为1.2mol,而900℃时CO的物质的量应为1.6mol,说明升高温度平衡向逆反应方向移动,则正反应为放热反应;实验2中达到平衡时,c(CO2)=c(H2)=
| 0.4mol |
| 2L |
c(CO)=
| 1.6mol |
| 2L |
| 1mol-0.4mol |
| 2L |
| 0.2×0.2 |
| 0.8×0.3 |
故答案为:放热;0.17;
(3)a、及时分离出CH3OH气体,平衡向着向着移动,但是甲醇浓度减小,反应速率减小,故a错误;
b、升高温度反应速率增大,但是平衡向逆反应方向移动,故a错误;
b.充入He(g),使体系压强增大,但平衡没有移动,故b错误;
c.保持容器的容积不变,再充入1mol CO2和3mol H2,压强增大,反应速率增大,且平衡向着正向移动,故c正确;
d.选择高效的催化剂,催化剂只影响化学反应速率,不影响平衡移动,故d错误;
故答案为:c.
点评:本题考查化学平衡计算以及化学平衡移动等问题,题目难度中等,本题注意(2)为易错点,注意把握等效平衡的理解.

练习册系列答案
相关题目
 CO(g)+H2(g)△H=+131.3kJ?mol-1,
CO(g)+H2(g)△H=+131.3kJ?mol-1,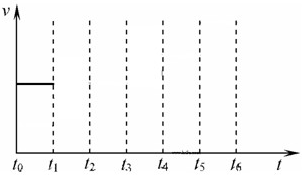 在一体积不变的容器中,当合成氨反应达到平衡后,在t1时升高温度,t2重新达到平衡,t3时充入氮气,t4时重新达到平衡,t5时移去一部分产物,t6时又达到平衡,请在下面的反应速率与时间关系图中画出t1到t5逆反应速率、t5到t6正反应速率的变化情况.
在一体积不变的容器中,当合成氨反应达到平衡后,在t1时升高温度,t2重新达到平衡,t3时充入氮气,t4时重新达到平衡,t5时移去一部分产物,t6时又达到平衡,请在下面的反应速率与时间关系图中画出t1到t5逆反应速率、t5到t6正反应速率的变化情况.
 煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.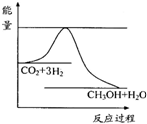 (2009?徐州二模)煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
(2009?徐州二模)煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.