题目内容
(2009?南京二模)选做题,本题有A、B两题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容,请选择其中一题作答,并把所选题目对应字母后的方框涂黑.若两题都作答,将按A题评分.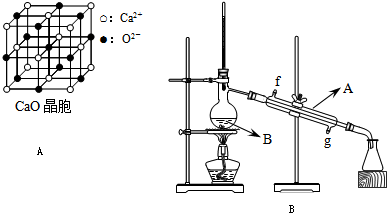
A.可以由下列反应合成三聚氰胺:
CaO+3C
CaC2+CO↑ CaC2+N2
CaCN2+C↑ CaCN2+2H2O=NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺.
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:
(2)尿素分子中C原子采取
 ,其中碳氧原子之间的共价键是
,其中碳氧原子之间的共价键是
A.2个σ键 B.2个π键 C.1个σ键、1个π键
(3)三聚氰胺(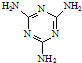 )俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸( 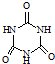 )后,三聚氰酸与三聚氰胺分子相互之间通过
)后,三聚氰酸与三聚氰胺分子相互之间通过
(4)CaO晶胞如图A所示,CaO晶体中Ca2+的配位数为
B.实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的物理性质如下表.请回答有关问题.
Ⅰ.乙酸正丁酯粗产品的制备
在干燥的50mL圆底烧瓶中,装入沸石,加入11.5mL正丁醇和9.4mL冰醋酸,再加3~4滴浓硫酸.然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管,加热冷凝回流反应.
(1)本实验过程中可能产生多种有机副产物,写出其中两种的结构简式:
(2)实验中为了提高乙酸正丁酯的产率,采取的措施是:
Ⅱ.乙酸正丁酯粗产品的制备
(1)将乙酸正丁酯粗产品用如下的操作进行精制:①水洗 ②蒸馏 ③用无水MgSO4干燥 ④用10%碳酸钠洗涤,正确的操作步骤是
A.①②③④B.③①④②C.①④①③②D.④①③②③
(2)将酯层采用如图B所示装置蒸馏.
1.出图中仪器A的名称
2.②蒸馏收集乙酸正丁酯产品时,应将温度控制在
Ⅲ.计算产率
测量分水器内由乙酸与正丁醇反应生成的水体积为1.8mL,假设在制取乙酸正丁酯过程中反应物和生成物没有损失,且忽略副反应,计算乙酸正丁酯的产率

A.可以由下列反应合成三聚氰胺:
CaO+3C
| ||
| ||
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:
1s22s22p63s23p63d104s2或[Ar]3d104s2
1s22s22p63s23p63d104s2或[Ar]3d104s2
.CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有N2O和CO2
CO2
(填化学式),由此可以推知CN22-离子的空间构型为直线形
直线形
.(2)尿素分子中C原子采取
sp2
sp2
杂化.尿素分子的结构简式是

C
C
(填字母)A.2个σ键 B.2个π键 C.1个σ键、1个π键
(3)三聚氰胺(
 )俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(  )后,三聚氰酸与三聚氰胺分子相互之间通过
)后,三聚氰酸与三聚氰胺分子相互之间通过分子间氢键
分子间氢键
结合,在肾脏内易形成结石.(4)CaO晶胞如图A所示,CaO晶体中Ca2+的配位数为
6
6
.CaO晶体和NaCl晶体的晶格能分别为:CaO 3401kJ/mol、NaCl 786kJ/mol.导致两者晶格能差异的主要原因是CaO晶体中Ca 2+、O 2-的带电量大于NaCl晶体中Na+、Cl-的带电量
CaO晶体中Ca 2+、O 2-的带电量大于NaCl晶体中Na+、Cl-的带电量
.B.实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的物理性质如下表.请回答有关问题.
| 化合物 | 密度/g?cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 0.810 | 118.0 | 9 |
| 冰醋酸 | 1.049 | 118.1 | ∞ |
| 乙酸正丁酯 | 0.882 | 126.1 | 0.7 |
在干燥的50mL圆底烧瓶中,装入沸石,加入11.5mL正丁醇和9.4mL冰醋酸,再加3~4滴浓硫酸.然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管,加热冷凝回流反应.
(1)本实验过程中可能产生多种有机副产物,写出其中两种的结构简式:
CH3CH2CH2CH2OCH2CH2CH2CH3
CH3CH2CH2CH2OCH2CH2CH2CH3
、CH2=CHCH2CH3
CH2=CHCH2CH3
.(2)实验中为了提高乙酸正丁酯的产率,采取的措施是:
用分水器及时移走反应生成的水,减少生成物的浓度;
用分水器及时移走反应生成的水,减少生成物的浓度;
、使用过量醋酸,提高正丁醇的转化率
使用过量醋酸,提高正丁醇的转化率
.Ⅱ.乙酸正丁酯粗产品的制备
(1)将乙酸正丁酯粗产品用如下的操作进行精制:①水洗 ②蒸馏 ③用无水MgSO4干燥 ④用10%碳酸钠洗涤,正确的操作步骤是
C
C
(填字母).A.①②③④B.③①④②C.①④①③②D.④①③②③
(2)将酯层采用如图B所示装置蒸馏.
1.出图中仪器A的名称
冷凝管
冷凝管
.冷却水从下
下
口进入(填字母).2.②蒸馏收集乙酸正丁酯产品时,应将温度控制在
126.1℃
126.1℃
左右.Ⅲ.计算产率
测量分水器内由乙酸与正丁醇反应生成的水体积为1.8mL,假设在制取乙酸正丁酯过程中反应物和生成物没有损失,且忽略副反应,计算乙酸正丁酯的产率
79.4%
79.4%
.分析:A(1)与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子是锌,根据构造原理写出该原子的核外电子排布式;根据等电子体的概念确定与CN22-互为等电子体的分子,根据二氧化碳的空间构型确定CN22-离子的空间构型.
(2)根据价层电子对互斥理论确定尿素的VSEPR模型,根据模型确定其杂化方式;根据其最简式确定其化学键类型.
(3)氢键普遍存在于已经与N、O、F等电负性很大的原子形成共价键的氢原子与另外的N、O、F等电负性很大的原子之间.
(4)以钙离子为中心,沿X、Y、Z三轴进行切割,从而确定钙离子配位数;晶格能大小与离子带电量成正比,与离子半径成反比.
BⅠ(1)醇在一定条件下能发生分子内或分子间脱水生成醚或烯烃;
(2)根据影响化学平衡移动的方法判断,减少生成物的量或增大另一种反应物的量都能使平衡向正反应方向移动.
Ⅱ.(1)根据各物质的溶解性及性质进行排序.
(2)1起冷凝作用的仪器是冷凝管,水从下口进上口出.
2.②根据酯的沸点控制温度.
Ⅲ.先根据酸的量计算理论上酯的量,再根据水的量计算酯的量,实际上酯的量与理论值之比即为酯的产率.
(2)根据价层电子对互斥理论确定尿素的VSEPR模型,根据模型确定其杂化方式;根据其最简式确定其化学键类型.
(3)氢键普遍存在于已经与N、O、F等电负性很大的原子形成共价键的氢原子与另外的N、O、F等电负性很大的原子之间.
(4)以钙离子为中心,沿X、Y、Z三轴进行切割,从而确定钙离子配位数;晶格能大小与离子带电量成正比,与离子半径成反比.
BⅠ(1)醇在一定条件下能发生分子内或分子间脱水生成醚或烯烃;
(2)根据影响化学平衡移动的方法判断,减少生成物的量或增大另一种反应物的量都能使平衡向正反应方向移动.
Ⅱ.(1)根据各物质的溶解性及性质进行排序.
(2)1起冷凝作用的仪器是冷凝管,水从下口进上口出.
2.②根据酯的沸点控制温度.
Ⅲ.先根据酸的量计算理论上酯的量,再根据水的量计算酯的量,实际上酯的量与理论值之比即为酯的产率.
解答:解:A(1)与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子是锌,根据构造原理,基态的锌原子核外电子排布式为1s22s22p63s23p63d104s2或[Ar]3d104s2;与CN22-互为等电子体的分子有N2O和CO2;等电子体具有相同的价电子数、原子总数,结构相似,二氧化碳分子是直线型,所以CN22-离子的空间构型是直线型.
故答案为:1s22s22p63s23p63d104s2或[Ar]3d104s2;CO2;直线型.
(2)CO(NH2)2分子中中心原子C原子上含有三个σ键一个π键,所以空间构型是平面三角形的,碳原子采取sp2杂化,尿素分子的结构简式是 ,其中碳氧原子之间的共价键是1个σ键、1个π键
,其中碳氧原子之间的共价键是1个σ键、1个π键
,故选C.
故答案为:sp2, ,C.
,C.
(3)三聚氰酸与三聚氰胺分子相互之间能形成氢键,所以是通过分子间氢键结合,在肾脏内易形成结石.
故答案为分子间氢键.
(4)以钙离子为中心,沿X、Y、Z三轴进行切割,结合图片知,钙离子的配位数是6;
晶格能大小与离子带电量成正比,CaO晶体中Ca 2+、O 2-的带电量大于NaCl晶体中Na+、Cl-的带电量,导致氯化钠的晶格能大于氧化钙的晶格能.
故答案为:6,CaO晶体中Ca 2+、O 2-的带电量大于NaCl晶体中Na+、Cl-的带电量.
BⅠ(1)醇在一定条件下能发生分子内或分子间脱水生成醚或烯烃,所以该条件下,正丁醇能发生分子间脱水形成醚CH3CH2CH2CH2OCH2CH2CH2CH3,也能形成分子内脱水生成正丁烯CH2=CHCH2CH3.
故答案为:CH3CH2CH2CH2OCH2CH2CH2CH3;CH2=CHCH2CH3.
(2)实验中为了提高乙酸正丁酯的产率,使反应向正反应方向移动,所以采取的措施是用分水器及时移走反应生成的水,减少生成物的浓度;使用过量醋酸,提高正丁醇的转化率.
故答案为:用分水器及时移走反应生成的水,减少生成物的浓度;使用过量醋酸,提高正丁醇的转化率.
Ⅱ.(1)因为正丁醇和乙酸都具有挥发性,所以制取的酯中含有正丁醇和乙酸,第一步水洗除去酯中的正丁醇和乙酸;
第二步用10%碳酸钠洗涤除去乙酸;
第三步用水洗涤除去碳酸钠溶液;
第四步用无水硫酸镁干燥除去水;
第五步蒸馏,制得较纯净的酯.
故选C.
(2)1起冷凝作用的仪器名称是冷凝管,为防止炸裂冷凝管,水应从下口进上口出.
2根据酯的温度知,温度应控制在126.1℃.
故答案为:冷凝管;下;126.1℃.
Ⅲ.正丁醇的质量=0.810 g/mL×11.5mL=9.315g;冰醋酸的质量=1.049g/mL×9.4mL=9.86g;
先根据方程式判断哪种物质过量,以不足量的为标准进行计算.
理论上9.315g正丁醇完全反应生成酯的质量为xg,生成1.8g水时同时生成酯的质量是yg.
乙酸和正丁醇的反应方程式为CH3COOH+CH3CH2CH2CH2OH
CH3COOCH2CH2CH2CH3+H2O
60g 74g 116g 18g
9.315g xg
yg 1.8g
所以x=14.6
y=11.6
乙酸正丁酯的产率=
×100%=79.4%.
故答案为79.4%.
故答案为:1s22s22p63s23p63d104s2或[Ar]3d104s2;CO2;直线型.
(2)CO(NH2)2分子中中心原子C原子上含有三个σ键一个π键,所以空间构型是平面三角形的,碳原子采取sp2杂化,尿素分子的结构简式是
 ,其中碳氧原子之间的共价键是1个σ键、1个π键
,其中碳氧原子之间的共价键是1个σ键、1个π键,故选C.
故答案为:sp2,
 ,C.
,C.(3)三聚氰酸与三聚氰胺分子相互之间能形成氢键,所以是通过分子间氢键结合,在肾脏内易形成结石.
故答案为分子间氢键.
(4)以钙离子为中心,沿X、Y、Z三轴进行切割,结合图片知,钙离子的配位数是6;
晶格能大小与离子带电量成正比,CaO晶体中Ca 2+、O 2-的带电量大于NaCl晶体中Na+、Cl-的带电量,导致氯化钠的晶格能大于氧化钙的晶格能.
故答案为:6,CaO晶体中Ca 2+、O 2-的带电量大于NaCl晶体中Na+、Cl-的带电量.
BⅠ(1)醇在一定条件下能发生分子内或分子间脱水生成醚或烯烃,所以该条件下,正丁醇能发生分子间脱水形成醚CH3CH2CH2CH2OCH2CH2CH2CH3,也能形成分子内脱水生成正丁烯CH2=CHCH2CH3.
故答案为:CH3CH2CH2CH2OCH2CH2CH2CH3;CH2=CHCH2CH3.
(2)实验中为了提高乙酸正丁酯的产率,使反应向正反应方向移动,所以采取的措施是用分水器及时移走反应生成的水,减少生成物的浓度;使用过量醋酸,提高正丁醇的转化率.
故答案为:用分水器及时移走反应生成的水,减少生成物的浓度;使用过量醋酸,提高正丁醇的转化率.
Ⅱ.(1)因为正丁醇和乙酸都具有挥发性,所以制取的酯中含有正丁醇和乙酸,第一步水洗除去酯中的正丁醇和乙酸;
第二步用10%碳酸钠洗涤除去乙酸;
第三步用水洗涤除去碳酸钠溶液;
第四步用无水硫酸镁干燥除去水;
第五步蒸馏,制得较纯净的酯.
故选C.
(2)1起冷凝作用的仪器名称是冷凝管,为防止炸裂冷凝管,水应从下口进上口出.
2根据酯的温度知,温度应控制在126.1℃.
故答案为:冷凝管;下;126.1℃.
Ⅲ.正丁醇的质量=0.810 g/mL×11.5mL=9.315g;冰醋酸的质量=1.049g/mL×9.4mL=9.86g;
先根据方程式判断哪种物质过量,以不足量的为标准进行计算.
理论上9.315g正丁醇完全反应生成酯的质量为xg,生成1.8g水时同时生成酯的质量是yg.
乙酸和正丁醇的反应方程式为CH3COOH+CH3CH2CH2CH2OH
| 浓硫酸 |
| △ |
60g 74g 116g 18g
9.315g xg
yg 1.8g
所以x=14.6
y=11.6
乙酸正丁酯的产率=
| 11.6g |
| 14.6g |
故答案为79.4%.
点评:本题考查了物质结构和有机化学综合题,难度不大,易错点是配位数的确定,以一种微粒为中心,沿X、Y、Z三轴进行切割,从而确定配位数.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 下列说法错误的是( )
下列说法错误的是( )