网址:http://m.1010jiajiao.com/timu3_id_345653[举报]
 环境中常见的重金属污染有:汞、铅、锰、铬、镉.处理工业废水中常含有的Cr2O72-和CrO
环境中常见的重金属污染有:汞、铅、锰、铬、镉.处理工业废水中常含有的Cr2O72-和CrO2- 4 |
方法1:还原沉淀法
该法的工艺流程为:
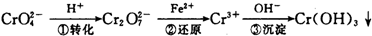
其中第①步存在平衡:2CrO
2- 4 |
2- 7 |
(1)写出第①步反应的平衡常数表达式
(2)关于第①步反应,下列说法正确的是
A.通过测定溶液的pH值可以判断反应是否已达平衡状态
B.该反应为氧化还原反应
C.强酸性环境,溶液的颜色为橙色
(3)第②步中,还原0.1mol Cr2O
2- 3 |
(4)第③步除生成的Cr(OH)3,还可能生成的沉淀为
Cr(OH)3(s)?Cr3+(aq)+3OH(aq),常温下,Cr(OH)3的溶度积K sp=10-32,当c(Cr3+)降至10-5 mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH值调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)
方法2:电解法
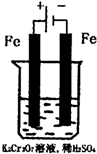
(5)实验室利用如图装置模拟电解法处理含Cr2O
2- 3 |
方法1:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑
KH(IO3)2+KOH=2KIO3+H2O
方法2:碱性条件下,KI+3H2O
| ||
方法3:I2
| H2O2,H+ |
| 70℃ |
| K2CO3 |
(1)与方法3相比方法1的不足是
(2)方法2选用的电极是惰性电极,则其阳极反应式是
(3)方法3反应温度控制在70℃左右,不采用更高温度的主要原因是
(4)制备纯净KIO3的实验步骤中,最后需将所得晶体最好使用
(5)已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;I2+2S2O32-=2I-+S4O62-.为测定加碘食盐中碘的含量,设计的方案如下.请完善实验步骤并计算测定结果:
a.准确称取w g食盐于锥形瓶中,再加适量蒸馏水使其完全溶解.
b.
c.向锥形瓶中滴加2.0×1 0-3mol/L Na2S2O3标准溶液至终点.d.重复上述实验两次.
| 滴定次数 | 盛标准Na2S2O4溶液的读数 | |
| 滴定前刻度(/mL) | 滴定后刻度(/mL) | |
| 1 | 1.02 | 11.03 |
| 2 | 2.00 | 11.99 |
| 3 | 0.20 | 10.20 |
| 1270 |
| 3w |
| 1270 |
| 3w |
(11分)化学兴趣小组设计以下实验方案,测定已部分变质的某小苏打样品中Na2CO3的质量分数。
[方案一]称取一定质量样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为:
________________________________________________________________________。
(2)实验中需加热至恒重的目的是:
________________________________________________________________________。
(3)实验中确定加热至恒重的方法是:
________________________________________________________________________。
(4)若加热过程中坩埚内有晶体迸溅出来,则测得的结果________(填“偏大”、“偏小”或“不变”)。
[方案二]称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤,干燥沉淀,称量固体质量,计算。(已知:Ba2++OH-+HCO3-===BaCO3↓+H2O)
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为______________。
(2)实验中判断沉淀是否完全的方法是
________________________________________________________________________________________________________________________________________。
(3)实验中洗涤沉淀的操作是
________________________________________________________________________。
(4)实验中判断沉淀是否洗涤干净的方法是
_______________________________________________________________________________________________________________________________________________。
[方案三]
按如图所示装置进行实验:
(1)B装置内所盛试剂是________;D装置的作用是______________;分液漏斗中________(填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(2)实验前称取17.9 g样品,实验后测得C装置增重8.8 g,则样品中Na2CO3的质量分数为________。
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷是:____________________。
查看习题详情和答案>>
(16分)环境中常见的重金属污染有:汞、铅、锰、铬、镉。处理工业废水中常含有的Cr2O2-7和CrO2-4离子,常用的方法有两种。
方法1:还原沉淀法
该法的工艺流程为:

其中第①步存在平衡:

(1)写出第①步反应的平衡常数表达式 。
(2)关于第①步反应,下列说法正确的是 。
A.通过测定溶液的pH值可以判断反应是否已达平衡状态[来源:Zxxk.Com]
B.该反应为氧化还原反应
C.强酸性环境,溶液的颜色为橙色
(3)第②步中,还原0.1 molCr2O2-7离子,需要 mol的FeSO4·7H2O。
(4)第③步除生成的Cr(OH)3,还可能生成的沉淀为
。在溶液中存在以下沉淀溶解平衡: 常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH值调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)
常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH值调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)
方法2:电解法
(5)实验室利用如图装置模拟电解法处理含Cr2O2-7的废水,电解时阳极反应式为 ,阴极区反应式为 ,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是 。

查看习题详情和答案>>
为了预防碘缺乏病,有关部门规定食盐中的碘含量(以I计)应在20~50 mg/Kg。制备KIO3的方法如下:
方法1:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑;KH(IO3)2+KOH=2KIO3+H2O
方法2:碱性条件下,
方法3:
⑴与方法3相比方法1的不足是 ,方法2的不足是 。
⑵方法2选用的电极是惰性电极,则其阳极反应式是 。
⑶方法3反应温度控制在70℃左右,不采用更高温度的主要原因是 。
⑷制备纯净KIO3的实验步骤中,最后需将所得晶体最好使用 洗涤2~3次,干燥后得产品。
⑸已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O; I2+2S2O32-=2I-+S4O62-。为测定加碘食盐中碘的含量,设计的方案如下。请完善实验步骤并计算测定结果:
I2+2S2O32-=2I-+S4O62-。为测定加碘食盐中碘的含量,设计的方案如下。请完善实验步骤并计算测定结果:
a.准确称取w g食盐于锥形瓶中,再加适量蒸馏水使其完全溶解。
b. 。
c.向锥形瓶中滴加2.0×10-3 mol/L Na2S2O3标准溶液至终点。
d.重复上述实验两次。
三次实验的数据记录如下表。则所测加碘食盐样品中的碘元素含量是 mg/kg(以含w的代数式表示)。
| 滴定次数 | 盛标准Na2S2O3溶液的读数 | |
| 滴定前刻度(/mL) | 滴定后刻度(/mL) | |
| 1 | 1.02 | 11.03 |
| 2 | 2.00 | 11.99 |
| 3 | 0.20 | 10.20 |