题目内容
 环境中常见的重金属污染有:汞、铅、锰、铬、镉.处理工业废水中常含有的Cr2O72-和CrO
环境中常见的重金属污染有:汞、铅、锰、铬、镉.处理工业废水中常含有的Cr2O72-和CrO2- 4 |
方法1:还原沉淀法
该法的工艺流程为:
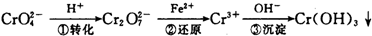
其中第①步存在平衡:2CrO
2- 4 |
2- 7 |
(1)写出第①步反应的平衡常数表达式
(2)关于第①步反应,下列说法正确的是
A.通过测定溶液的pH值可以判断反应是否已达平衡状态
B.该反应为氧化还原反应
C.强酸性环境,溶液的颜色为橙色
(3)第②步中,还原0.1mol Cr2O
2- 3 |
(4)第③步除生成的Cr(OH)3,还可能生成的沉淀为
Cr(OH)3(s)?Cr3+(aq)+3OH(aq),常温下,Cr(OH)3的溶度积K sp=10-32,当c(Cr3+)降至10-5 mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH值调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)
方法2:电解法
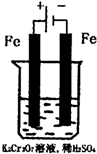
(5)实验室利用如图装置模拟电解法处理含Cr2O
2- 3 |
分析:(1)根据化学平衡常数表达式的概念解决;
(2)根据平衡装状态判断标准;氧化还原反应的概念;化学平衡的移动,结合题意解决;
(3)根据氧化还原反应的计算解决;
(4)根据化学反应过程的分析判断离子种类,得出产物;根据溶度积常数计算,确定溶液中离子是否沉淀完全;
(5)根据电解池阴、阳两极微粒的放电顺序解决;结合阴阳两极的放电引起的溶液中离子变化解决.
(2)根据平衡装状态判断标准;氧化还原反应的概念;化学平衡的移动,结合题意解决;
(3)根据氧化还原反应的计算解决;
(4)根据化学反应过程的分析判断离子种类,得出产物;根据溶度积常数计算,确定溶液中离子是否沉淀完全;
(5)根据电解池阴、阳两极微粒的放电顺序解决;结合阴阳两极的放电引起的溶液中离子变化解决.
解答:解:(1)根据平衡常数表达式的概念,结合方程式2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O可知,K=
,
故答案为:K=
;
(2)A? 根据化学平衡状态的判断标准,结合可逆反应方程式2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O,随着反应的进行,溶液中c(H+)逐渐减小,当溶液中c(H+)保持不变时,即到达平衡状态,此时,溶液的pH不变,故A正确;
B? 根据氧化反应的概念,一个反应中有元素化合价升降的,就为氧化还原反应,而此选项中,只有化合价的升高,没有化合价降低的元素,因此次变化是一个氧化还原反应中氧化过程,不是一个完整的氧化还原反应,故B错误;
C? 根据影响化学平衡移动的条件,结合题意,强酸环境下,相当于增加了c(H+)的浓度,反应2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O向正向移动,即溶液颜色为橙色.故C正确,
故答案为:AC;
(3)根据氧化还原反应的计算,氧化剂得到的电子总数与还原剂失去电子总数相等.根据Cr2O72-→2Cr3+,1molCr2O72-被还原得到6mol电子,现在有0.1molCr2O72-被还原被还原,需得到0.6mol电子,0.6mol电子将有Fe2+失去变成Fe3+,1molFe2+变成Fe3+,将失去1mol电子,现在失去0.6mol电子,需要0.6mol FeSO4?7H2O,
故答案为:0.6;
(4)根据分析(3)当Cr2O
→2Cr3+变化时,溶液中产生了Cr3+的同时,又发生了Fe2+→Fe3+的过程 溶液中又产生了Fe3+,因此加入OH-又有Fe(OH)3生成.故答案为Fe(OH)3;根据溶度积常数的计算,结合Cr(OH)3(s)?Cr3+(aq)+3OH(aq),当溶液的pH值调至4时,c(OH-)=1×10-10,常温下,Cr(OH)3的溶度积K sp=10-32,Ksp(Cr(OH)3)=c3(OH)?c(Cr3+),c(Cr3+)=
=
=10-2mol/L>10-5 mol/L,
故答案为:若pH值调整至4时已形成部分沉淀;
(5)根据电解池阴阳两极的放电顺序,金属单质做阳极时,金属优先失电子,次电解池阳极是铁,故阳极反应为:Fe-2e-=Fe2+;阴极的放电顺序与金属活动性顺序相反,在K2Cr2O7、H2SO4的溶液中,含有的阳离子有:K+、H+,H+的放电能力比K+的强,因此阴极上是H+离子放电,H+浓度减小促进了水的电离平衡,使水向电离的方向移动,OH-离子的浓度增大,碱性增强,使得到的金属阳离子在阴极区可沉淀完全,
故答案为:2H++2e-=H2↑;由于阴极发生2H++2e-=H2↑;阴极反应消耗了H+,打破了水的电离平衡,促进了水的电离,是溶液中OH-的浓度增大,溶液逐渐呈碱性.
| ||
|
故答案为:K=
| ||
|
(2)A? 根据化学平衡状态的判断标准,结合可逆反应方程式2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O,随着反应的进行,溶液中c(H+)逐渐减小,当溶液中c(H+)保持不变时,即到达平衡状态,此时,溶液的pH不变,故A正确;
B? 根据氧化反应的概念,一个反应中有元素化合价升降的,就为氧化还原反应,而此选项中,只有化合价的升高,没有化合价降低的元素,因此次变化是一个氧化还原反应中氧化过程,不是一个完整的氧化还原反应,故B错误;
C? 根据影响化学平衡移动的条件,结合题意,强酸环境下,相当于增加了c(H+)的浓度,反应2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O向正向移动,即溶液颜色为橙色.故C正确,
故答案为:AC;
(3)根据氧化还原反应的计算,氧化剂得到的电子总数与还原剂失去电子总数相等.根据Cr2O72-→2Cr3+,1molCr2O72-被还原得到6mol电子,现在有0.1molCr2O72-被还原被还原,需得到0.6mol电子,0.6mol电子将有Fe2+失去变成Fe3+,1molFe2+变成Fe3+,将失去1mol电子,现在失去0.6mol电子,需要0.6mol FeSO4?7H2O,
故答案为:0.6;
(4)根据分析(3)当Cr2O
2- 7 |
| Ksp(Cr(OH)3) |
| c3(OH-) |
| 10-32 |
| 103×-10 |
故答案为:若pH值调整至4时已形成部分沉淀;
(5)根据电解池阴阳两极的放电顺序,金属单质做阳极时,金属优先失电子,次电解池阳极是铁,故阳极反应为:Fe-2e-=Fe2+;阴极的放电顺序与金属活动性顺序相反,在K2Cr2O7、H2SO4的溶液中,含有的阳离子有:K+、H+,H+的放电能力比K+的强,因此阴极上是H+离子放电,H+浓度减小促进了水的电离平衡,使水向电离的方向移动,OH-离子的浓度增大,碱性增强,使得到的金属阳离子在阴极区可沉淀完全,
故答案为:2H++2e-=H2↑;由于阴极发生2H++2e-=H2↑;阴极反应消耗了H+,打破了水的电离平衡,促进了水的电离,是溶液中OH-的浓度增大,溶液逐渐呈碱性.
点评:本题是一道综合题,集中考查了难溶物的溶解平衡、利用溶度积常数的计算、溶解平衡的移动、电解原理等知识点,综合性较强,很容易出错,特别是简答题,如何将学到的知识组织成答案是关键.

练习册系列答案
相关题目
下列关于硅酸盐材料的说法错误的是( )
| A、生活中常见的硅酸盐材料有玻璃、水泥、陶瓷 | B、普通玻璃的主要成分是SiO2 | C、陶瓷的主要原料是黏土 | D、硅酸盐水泥以石灰石和黏土为主要原料 |
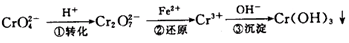

 常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH值调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)
常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH值调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)


 常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH值调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)
常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH值调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)