摘要: Fe
网址:http://m.1010jiajiao.com/timu3_id_344097[举报]
Fe是人体不可缺少的微量元素,摄入含铁化合物可补充铁.硫酸亚铁晶体(FeSO4?7H2O)在医药上作补血剂.某课外小组测定该补血剂中铁元素的含量.实验步骤如下:
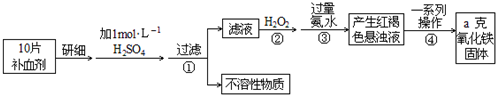
请回答下列问题:
(1)步骤②加入过量H2O2的目的:
(2)步骤③中反应的离子方程式:
(3)步骤④中一系列处理的操作步骤:
(4)实验中用浓硫酸配制1mol/L的稀硫酸,配制时用到定量的玻璃仪器有
(5)若实验无损耗,则每片补血剂含铁元素的质量
查看习题详情和答案>>

请回答下列问题:
(1)步骤②加入过量H2O2的目的:
将Fe2+全部氧化为Fe3+
将Fe2+全部氧化为Fe3+
;(2)步骤③中反应的离子方程式:
Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+
Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+
;(3)步骤④中一系列处理的操作步骤:
过滤
过滤
、洗涤、灼烧
灼烧
、冷却、称量.(4)实验中用浓硫酸配制1mol/L的稀硫酸,配制时用到定量的玻璃仪器有
容量瓶
容量瓶
、量筒
量筒
(答出两个仪器).(5)若实验无损耗,则每片补血剂含铁元素的质量
0.07a
0.07a
g(用含a的代数式表示).Fe(OH)3胶体的制备:将烧杯中的25ml蒸馏水加热至沸腾,向沸水中逐滴加入5~6滴饱和
查看习题详情和答案>>
FeCl3溶液
FeCl3溶液
,继续煮沸至溶液呈红褐色
红褐色
,停止加热,即制得Fe(OH)3胶体.反应的化学方程式:FeCl3+3H2O
Fe(OH)3(胶体)+3HCl
| ||
FeCl3+3H2O
Fe(OH)3(胶体)+3HCl
.
| ||
Fe(OH)2很不稳定,露置在空气中容易被氧化,Fe(OH)2被氧化的化学方程为:
(1)用硫酸亚铁晶体配制上述FeSO4溶液时你觉得还需加入
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是
(4)检验Fe3+存在的最佳试剂是
(5)写出Fe与H20在一定条件下反应的化学方程式
查看习题详情和答案>>
4Fe(OH)2+O2+2H2O=4Fe(OH)3
4Fe(OH)2+O2+2H2O=4Fe(OH)3
.为了获得白色的Fe(OH)2沉淀,可以用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备.(1)用硫酸亚铁晶体配制上述FeSO4溶液时你觉得还需加入
铁粉
铁粉
.(2)除去蒸馏水中溶解的O2常采用加热至沸腾
加热至沸腾
的方法.(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是
防止空气随着NaOH溶液的加入进入溶液
防止空气随着NaOH溶液的加入进入溶液
.(4)检验Fe3+存在的最佳试剂是
KSCN溶液
KSCN溶液
,现象是溶液变为血红色
溶液变为血红色
.(5)写出Fe与H20在一定条件下反应的化学方程式
3Fe+4H20(g)
Fe3O4+4H2
| ||
3Fe+4H20(g)
Fe3O4+4H2
.
| ||
Fe和Al是两种常见的金属,将它们按一定的质量比组成混合物.
(1)取一定质量的该混合物,向其中加入足量NaOH溶液,生成气体在标准情况下的体积为aL,则反应的离子方程式为
mol
mol(用含字母的数学式表示).
(2)另取相同质量的混合物,向其中加入足量稀硫酸,固体全部溶解,生成气体在标准状况下的体积为bL,则反应中转移电子的物质的量为
mol
mol;混合物中Fe的质量为
查看习题详情和答案>>
(1)取一定质量的该混合物,向其中加入足量NaOH溶液,生成气体在标准情况下的体积为aL,则反应的离子方程式为
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
;混合物中Al的物质的量为| 5a |
| 168 |
| 5a |
| 168 |
(2)另取相同质量的混合物,向其中加入足量稀硫酸,固体全部溶解,生成气体在标准状况下的体积为bL,则反应中转移电子的物质的量为
| 5b |
| 56 |
| 5b |
| 56 |
2.5(b-a)g
2.5(b-a)g
(用含字母的数学式表示).