摘要:配平下列化学方程式或离子方程式.并回答有关问题. ① Fe3P+ HNO3 ─ Fe(NO3)3+ H3PO4 + NO+ ② 上述反应中.若有21mol电子转移时.生成是H3PO4是 mol.被还原的硝酸是 g. ③ 上述反应中.当生成1.8mol Fe3+时.放出NO的体积是 L.消耗的HNO3是 mol. (2)① P + CuSO4+ H2O ─ Cu3P+ H3PO4 + H2SO4 ②上述反应中.1molCuSO4氧化P的物质的量为 mol. (3) KIx + CL2 + H2O ─ KCl + HIO3 + 若KIx与CL2的系数比为1:8.则x值为 . (4) Clm+ OH- ─ Cl-+ + H2O (5) Na2Sx + NaClO + NaOH ─ Na2SO4+ NaCl+ H2O 若 Na2Sx 在反应中消耗的NaClO和NaOH的物质的量之比为2:1.试比求得的x值写出该多硫化钠的化学式 . (6) KClO4 + CrCl2 + H2SO4 + H2O ─ H2Cr2O7+ Cl2↑+ K2SO4 ① 氧化剂是 .还原剂是 .氧化产物是 , ② 若反应过程中.有0.5molCl2被还原出来.则有 molCrCl2发生了反应.并有 mol 电子发生了转移. (7) + + H+ = RO2 + Mn2++ H2O 上述反应中.若0.2mol离子参加反应时共转移0.4mol电子. ① x值= , ② 参加反应的氢离子的物质的量为 , ③ 若RO2在常温下为气体.则R属于 族元素.
网址:http://m.1010jiajiao.com/timu3_id_343846[举报]
回答下列问题
(1)试简述给FeSO4溶液中加入NaOH溶液时的反应现象并完成按顺序反应的化学方程式(或离子方程式)
现象 ;离子方程式① ;化学方程式②
(2)已知:某反应体系中的物质有:Fe(OH)3、NaClO、NaOH、NaCl、Na2FeO4(高铁酸钠)、H2O 其中Na2FeO4和H2O是产物中的二种.
①写出并配平反应的化学方程式: ;
②在该反应中:得电子的物质是 (化学式)失电子的物质是 (化学式)
③在该反应中,每有3mol的电子转移,消耗(生成)NaOH的物质的量是 mol.
④由方程式判定可知:NaClO和Na2FeO4的氧化性强弱顺序是 > .
查看习题详情和答案>>
(1)试简述给FeSO4溶液中加入NaOH溶液时的反应现象并完成按顺序反应的化学方程式(或离子方程式)
现象
(2)已知:某反应体系中的物质有:Fe(OH)3、NaClO、NaOH、NaCl、Na2FeO4(高铁酸钠)、H2O 其中Na2FeO4和H2O是产物中的二种.
①写出并配平反应的化学方程式:
②在该反应中:得电子的物质是
③在该反应中,每有3mol的电子转移,消耗(生成)NaOH的物质的量是
④由方程式判定可知:NaClO和Na2FeO4的氧化性强弱顺序是
某化学兴趣小组测定某FeCl3样品(只含少量FeCl2杂质)中铁元素的质量分数,按以下实验步骤进行操作:
①称取a g样品,置于烧杯中;
②加入适量盐酸和蒸馏水,使样品溶解,然后准确配制成250.00mL溶液;
③量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦….
请根据上面叙述,回答:
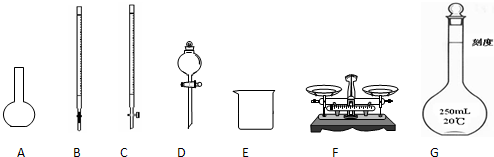
(1)图所示仪器中,本实验步骤①②③中必须用到的仪器是E和
(2)步骤②中加入盐酸的作用
(3)写出步骤④中发生反应的离子方程式
(4)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式
从理论上分析,上述实验中若将氯水改为NaClO3时,对实验结果造成
(5)第⑥步的操作中,将沉淀物转移到
(6)本实验需要称量的最少次数是
×100%
×100%.(列出算式,不需化简)
(7)已知Cl2与热的NaOH溶液可发生如下反应:
3Cl2+6NaOH
5NaCl+NaClO3+3H2O
则Fe3+、KClO3、Cl2三种物质其氧化性由强到弱的顺序是
查看习题详情和答案>>
①称取a g样品,置于烧杯中;
②加入适量盐酸和蒸馏水,使样品溶解,然后准确配制成250.00mL溶液;
③量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦….
请根据上面叙述,回答:

(1)图所示仪器中,本实验步骤①②③中必须用到的仪器是E和
CFG
CFG
(填字母).(2)步骤②中加入盐酸的作用
增强溶液酸性,抑止Fe2+Fe3+水解;
增强溶液酸性,抑止Fe2+Fe3+水解;
.(3)写出步骤④中发生反应的离子方程式
Fe3++3NH3?H2O═Fe(OH)3↓+3NH4+
Fe3++3NH3?H2O═Fe(OH)3↓+3NH4+
.(4)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式
6
6
Fe2++1
1
ClO3-+6
6
═6
6
Fe3++1
1
Cl-+3
3
H2O从理论上分析,上述实验中若将氯水改为NaClO3时,对实验结果造成
无影响
无影响
(填偏大、偏小或不影响),等物质的量的NaClO3与Cl2的氧化效率之比为3:1
3:1
(5)第⑥步的操作中,将沉淀物转移到
坩埚
坩埚
(填仪器名称)中加热,冷却至室温,称量其质量为m1g,再次加热并冷却至室温称量其质量为m2g,若m1与m2差值较大,接下来的操作应当是继续加热一段时间后,把坩埚放置于干燥器中冷却,再称量,至最后两次称得的质量差不超过0.1g为止
继续加热一段时间后,把坩埚放置于干燥器中冷却,再称量,至最后两次称得的质量差不超过0.1g为止
.(6)本实验需要称量的最少次数是
5
5
次,若容器质量是W1g,最终容器和固体的总质量是W2g,则样品中铁元素的质量分数为| 7(W2-W1) |
| a |
| 7(W2-W1) |
| a |
(7)已知Cl2与热的NaOH溶液可发生如下反应:
3Cl2+6NaOH
| ||
则Fe3+、KClO3、Cl2三种物质其氧化性由强到弱的顺序是
KClO3>Cl2>Fe3+
KClO3>Cl2>Fe3+
.Ⅰ.某化学课外活动小组以海带为原料获得少量碘水,并以四氯化碳为溶剂将碘从碘水中提取出来,具体过程如图所示.

请回答下列问题:
(1)操作②中发生反应的离子方程式为 .
(2)操作③为萃取,为什么可以用CCl4作为萃取剂? .
(3)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏.指出如图实验装置中存在的错误之处:① ;② ; ③ .

(4)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法: .
Ⅱ.FeSO4?7H2O是某些补血剂的主要成分,实验室为了测定某补血剂中铁元素的含量需要450ml 0.01mol/L的高锰酸钾溶液,配制高锰酸钾溶液时所用的仪器有天平、烧杯、胶头滴管及 ;用高锰酸钾溶液进行滴定时,标准高锰钾溶液应该放在 (填“酸式”或“碱式”)滴定管中.假如该实验用标准来滴定待测液,在滴定过程中常会因操作不正确而引起误差,下列操作中可以引起所测铁元素含量偏高的是 (用字母填写).
A.锥形瓶用待测液润洗
B.锥形瓶洗净后还留有蒸馏水
C.盛装标准液的滴定管洗净后未用标准润洗直接进行装液滴定
D.盛装高锰酸钾溶液的滴定管在滴定前读数正确,滴定后俯视读数.
查看习题详情和答案>>

请回答下列问题:
(1)操作②中发生反应的离子方程式为
(2)操作③为萃取,为什么可以用CCl4作为萃取剂?
(3)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏.指出如图实验装置中存在的错误之处:①

(4)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:
Ⅱ.FeSO4?7H2O是某些补血剂的主要成分,实验室为了测定某补血剂中铁元素的含量需要450ml 0.01mol/L的高锰酸钾溶液,配制高锰酸钾溶液时所用的仪器有天平、烧杯、胶头滴管及
A.锥形瓶用待测液润洗
B.锥形瓶洗净后还留有蒸馏水
C.盛装标准液的滴定管洗净后未用标准润洗直接进行装液滴定
D.盛装高锰酸钾溶液的滴定管在滴定前读数正确,滴定后俯视读数.
Ⅰ.某化学课外活动小组以海带为原料获得少量碘水,并以四氯化碳为溶剂将碘从碘水中提取出来,具体过程如图所示.

请回答下列问题:
(1)操作②中发生反应的离子方程式为______.
(2)操作③为萃取,为什么可以用CCl4作为萃取剂?______.
(3)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏.指出如图实验装置中存在的错误之处:①______;②______; ③______.

(4)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:______.
Ⅱ.FeSO4?7H2O是某些补血剂的主要成分,实验室为了测定某补血剂中铁元素的含量需要450ml 0.01mol/L的高锰酸钾溶液,配制高锰酸钾溶液时所用的仪器有天平、烧杯、胶头滴管及______;用高锰酸钾溶液进行滴定时,标准高锰钾溶液应该放在______(填“酸式”或“碱式”)滴定管中.假如该实验用标准来滴定待测液,在滴定过程中常会因操作不正确而引起误差,下列操作中可以引起所测铁元素含量偏高的是______(用字母填写).
A.锥形瓶用待测液润洗
B.锥形瓶洗净后还留有蒸馏水
C.盛装标准液的滴定管洗净后未用标准润洗直接进行装液滴定
D.盛装高锰酸钾溶液的滴定管在滴定前读数正确,滴定后俯视读数.
查看习题详情和答案>>
发射航天火箭常用氮的氢化物肼(N2H4)作燃料。试回答下列有关问题。
(1)写出N2的电子式_________________________________。
(2)液态NH3类似H2O,也能微弱电离且产生电子数相同的两种离子,则液态NH3电离方程式为_________________________________。
(3)25℃时,0.1 mol.L-1NH4NO3溶液中水的电离程度___________(填“大于”“等于”或“小于”)0.1 mol·L-1NaOH溶液中水的电离程度。若将0.1 mOl·L-1NaOH和0.2 m01.L-1 NH4NO3两溶液等体积混合,所得溶液中离子浓度由大到小的顺序为______________________。
(4)在结构上N2H4和NH3的关系有如H2O2和H2O的关系。N2H4能发生下列反应:
N2H4+H3O+====![]() + H2O
+ H2O
N2H4+ H2O![]()
![]() + OH-
+ OH-
![]() +H2O
+H2O![]()
![]() +OH-
+OH-
![]() +H2O
+H2O![]() N2H4+H3O+
N2H4+H3O+
据此可得出的结论是__________________。
A.肼水解显酸性 B.肼在水中电离出H+离子
C.肼是二元弱碱 D.肼是二元弱酸
(5)完成下列反应方程式并配平:
______NH3+______NaClO====NaCl+______N2H4+______ ______
(6)发射火箭时肼(N2H4)为燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知4gN2H4(g)在上述反应中放出71kJ的热量,写出该反应的热化学方程式)___________。
查看习题详情和答案>>