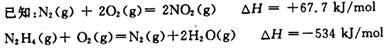题目内容
发射航天火箭常用氮的氢化物肼(N2H4)作燃料。试回答下列有关问题。(1)写出N2的电子式_________________________________。
(2)液态NH3类似H2O,也能微弱电离且产生电子数相同的两种离子,则液态NH3电离方程式为_________________________________。
(3)25℃时,0.1 mol.L-1NH4NO3溶液中水的电离程度___________(填“大于”“等于”或“小于”)0.1 mol·L-1NaOH溶液中水的电离程度。若将0.1 mOl·L-1NaOH和0.2 m01.L-1 NH4NO3两溶液等体积混合,所得溶液中离子浓度由大到小的顺序为______________________。
(4)在结构上N2H4和NH3的关系有如H2O2和H2O的关系。N2H4能发生下列反应:
N2H4+H3O+====![]() + H2O
+ H2O
N2H4+ H2O![]()
![]() + OH-
+ OH-
![]() +H2O
+H2O![]()
![]() +OH-
+OH-
![]() +H2O
+H2O![]() N2H4+H3O+
N2H4+H3O+
据此可得出的结论是__________________。
A.肼水解显酸性 B.肼在水中电离出H+离子
C.肼是二元弱碱 D.肼是二元弱酸
(5)完成下列反应方程式并配平:
______NH3+______NaClO====NaCl+______N2H4+______ ______
(6)发射火箭时肼(N2H4)为燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知4gN2H4(g)在上述反应中放出71kJ的热量,写出该反应的热化学方程式)___________。
(1)![]()
(2)2NH3![]()
![]() +
+![]()
(3)大于;c(![]() )>c(
)>c(![]() )>c(Na+)>c(OH-)>c(H+)
)>c(Na+)>c(OH-)>c(H+)
(4)C
(5)2 NH3+NaClO====N2H4+NaCl+H2O
(6)N2H4(g)+NO2(g)====![]() N2(g)+2H2O(g);ΔH=-568kJ/mol
N2(g)+2H2O(g);ΔH=-568kJ/mol
解析:此题考查离子浓度比较及一些常见化学用语(氧化还原反应,热化学方程式,电子式书写)。
0.1mol/LNaOH与0.2mol/LNH4NO3等体积混合后,溶液中首先发生反应:
NH4 NO3+NaOH====NH3·H2O+NaNO3
0.1mol 0.1 mol 0.1 mol 0.1 mol
反应后溶液中各溶质分别为
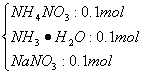
从而可比较出各离子浓度大小

| |||||||||||||||||||||||||||||||||