题目内容
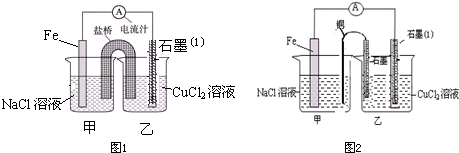
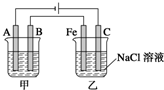 如图所示:甲、乙为相互串联的两电解池.试回答:
如图所示:甲、乙为相互串联的两电解池.试回答:(1)乙池中Fe极电极反应式为
2H++2e-═H2↑
2H++2e-═H2↑
,若在乙池中滴入少量酚酞试液,开始电解一段时间,铁极附近呈红
红
色.(2)甲池若为用电解原理精炼铜(假设粗铜的组成是均匀的,且比其活泼和不活泼的成分均存在)的装置,则A电极材料为
精铜
精铜
,电极反应式为Cu2++2e-═Cu
Cu2++2e-═Cu
,电解质溶液可以是CuSO4
CuSO4
;通电一段时间后,A极增重12.8g,则甲池溶液原溶质的浓度减小
减小
(填“增大”、“减小”、“不变”或“无法确定”),乙池C(石墨)极放出气体在标准状况下的体积为4.48
4.48
L,此时乙池剩余溶液的体积为400mL,则溶液的c(OH-)1mol/L
1mol/L
.若要使乙池溶液恢复到电解前的状态,可向溶液中加入HCl
HCl
(填写物质的化学式)14.6
14.6
g.分析:(1)依据电源分析,乙池中和电源正极连接的C电极为阳极,Fe为阴极,溶液中的氢离子得到电子发生还原反应生成氢气,溶液中氢氧根离子浓度增大,A为阴极,B为阳极;
(2)依据电解精炼原理分析判断,粗铜做阳极,精铜做阴极,含铜离子的电解质溶液;依据电极反应电子守恒计算放出气体体积和离子浓度,电解后溶液恢复浓度依据电解质溶液中出什么加什么的原则,依据电解化学方程式计算得到需要加入的物质质量;
(2)依据电解精炼原理分析判断,粗铜做阳极,精铜做阴极,含铜离子的电解质溶液;依据电极反应电子守恒计算放出气体体积和离子浓度,电解后溶液恢复浓度依据电解质溶液中出什么加什么的原则,依据电解化学方程式计算得到需要加入的物质质量;
解答:解:(1)装置图分析可知乙池中和电源正极连接的C电极为阳极,Fe为阴极,溶液中的氢离子得到电子发生还原反应生成氢气,电极反应为:2H++2e-═H2↑;溶液中氢氧根离子浓度增大,酚酞变红;
故答案为:2H++2e-═H2↑,红色;
(2)甲池若为用电解原理精炼铜,粗铜做阳极,精铜做阴极,含铜离子的电解质溶液;甲池中A为阴极,B为阳极;所以A电极材料为精铜,电极反应为:Cu2++2e-═Cu,B电极为粗铜,Cu-2e-═Cu2+,电解质溶液为硫酸铜溶液,通电一段时间后,甲池中阳极上粗铜中的铁、锌、镍等金属失电子,溶液中铜离子得到电子析出铜,所以溶液原溶质的浓度减小;
A极增重12.8g为铜,物质的量=
=0.2mol,转移电子物质的量为0.4mol;
乙池中C电极为阳极,溶液中氯离子失电子生成氯气,阳极电极反应为2Cl--2e-═Cl2↑,阴极电极反应:2H++2e-═H2↑;
电池反应为2NaCl+2H2O
2NaOH+H2↑+Cl2↑依据电子守恒,生成氯气物质的量0.2mol,反应的氢离子物质的量为0.4mol;
标准状况下体积=0.2mol×22.4L/mol=4.48L;
依据氢离子减少和氢氧根离子增多相同,溶液中氢氧根离子浓度=
=1mol/L;
依据电解池中的化学方程式可知恢复电解前溶液浓度需要通入氯化氢气体,化学方程式分析可知,生成氯气0.2mol,氢气为0.2mol;
需要氯化氢物质的量为0.4mol,质量=0.4mol×36.5g/mol=14.6g;
故答案为:精铜,Cu2++2e-═Cu,CuSO4,减小,4.48,1mol/L,HCl,14.6;
故答案为:2H++2e-═H2↑,红色;
(2)甲池若为用电解原理精炼铜,粗铜做阳极,精铜做阴极,含铜离子的电解质溶液;甲池中A为阴极,B为阳极;所以A电极材料为精铜,电极反应为:Cu2++2e-═Cu,B电极为粗铜,Cu-2e-═Cu2+,电解质溶液为硫酸铜溶液,通电一段时间后,甲池中阳极上粗铜中的铁、锌、镍等金属失电子,溶液中铜离子得到电子析出铜,所以溶液原溶质的浓度减小;
A极增重12.8g为铜,物质的量=
| 12.8g |
| 64g/mol |
乙池中C电极为阳极,溶液中氯离子失电子生成氯气,阳极电极反应为2Cl--2e-═Cl2↑,阴极电极反应:2H++2e-═H2↑;
电池反应为2NaCl+2H2O
| ||
标准状况下体积=0.2mol×22.4L/mol=4.48L;
依据氢离子减少和氢氧根离子增多相同,溶液中氢氧根离子浓度=
| 0.4mol |
| 0.4L |
依据电解池中的化学方程式可知恢复电解前溶液浓度需要通入氯化氢气体,化学方程式分析可知,生成氯气0.2mol,氢气为0.2mol;
需要氯化氢物质的量为0.4mol,质量=0.4mol×36.5g/mol=14.6g;
故答案为:精铜,Cu2++2e-═Cu,CuSO4,减小,4.48,1mol/L,HCl,14.6;
点评:本题考查了电解原理的分析应用,主要是电极反应,电极名称和电极计算的分析应用,电极原理的应用是解题关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
如图所示装置或操作不能达到实验目的是( )
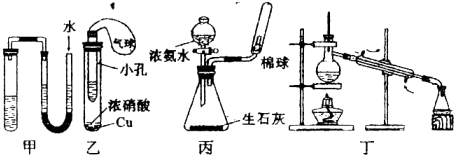

| A、利用甲装置检查装置的气密性 | B、利用乙装置制取NO2,井检验其还原性,小试管中的试剂可为淀粉-KI溶液 | C、利用丙装置制取并收集氨气 | D、利用丁装置分离沸点接近互不相溶的渡体混合物 |
 碳、氢、氧3种元素组成的有机物A,相对分子质量为152,其分子中C、H原子个数比为1:1,含氧元素的质量分数为31.58%.A遇FeCl3溶液显紫色,其苯环上的一氯取代物有两种,请回答下列问题:
碳、氢、氧3种元素组成的有机物A,相对分子质量为152,其分子中C、H原子个数比为1:1,含氧元素的质量分数为31.58%.A遇FeCl3溶液显紫色,其苯环上的一氯取代物有两种,请回答下列问题: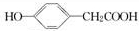
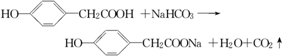
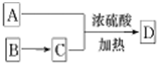 所示转化关系,D的分子式为C10H12O3,A与C反应的化学方程式
所示转化关系,D的分子式为C10H12O3,A与C反应的化学方程式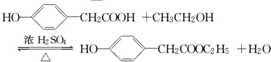
 某实验小组同学对电化学原理进行了一系列探究活动.
某实验小组同学对电化学原理进行了一系列探究活动.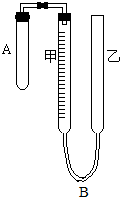 为了测定气体摩尔体积,用如图所示的装置和下列实验药品:将一定量锌片与足量的稀硫酸在试管A中反应,量气管B是由甲、乙两根玻璃管组成,它们用橡皮管连通,并装适量水,甲管有刻度,甲、乙管可固定在铁架台上,供量气用,乙管可上下移动,以调节液面高低.
为了测定气体摩尔体积,用如图所示的装置和下列实验药品:将一定量锌片与足量的稀硫酸在试管A中反应,量气管B是由甲、乙两根玻璃管组成,它们用橡皮管连通,并装适量水,甲管有刻度,甲、乙管可固定在铁架台上,供量气用,乙管可上下移动,以调节液面高低. 示)位于该正方体的顶点和面心,该化合物的化学式是
示)位于该正方体的顶点和面心,该化合物的化学式是