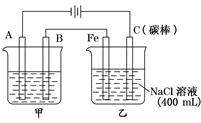
题目内容
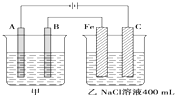 如图为相互串联的甲乙两个电解池,请回答:
如图为相互串联的甲乙两个电解池,请回答:(1)甲池若为用电解原理精炼铜的装置,A极是
阴极
阴极
,材料是精铜
精铜
,电极反应为Cu2++2e-=Cu
Cu2++2e-=Cu
;B极是阳极
阳极
,材料是粗铜
粗铜
,主要电极反应为Cu-2e-=Cu2+
Cu-2e-=Cu2+
,电解质溶液为CuSO4溶液
CuSO4溶液
.(2)乙池中若滴入少量酚酞试液,开始一段时间后,
Fe
Fe
极附近呈红色.(3)若甲槽阴极增重12.8g,则乙槽阳极放出气体在标准状况下的体积为
4.48L
4.48L
.(4)常温下若乙槽剩余液体为400mL,则电解后得到碱液的物质的量浓度为
1mol/L
1mol/L
.分析:图示是两个串联的电解池,依据电源判断A为阴极,B为阳极,Fe为阴极,C为阳极;
(1)依据电解原理精炼铜的装置是粗铜做阳极,精铜做阴极;含铜离子的溶液做电解质溶液;
(2)乙池中是电解饱和食盐水,溶液中的氢离子在阴极得到电子发生还原反应生成氢气,破坏了水的电离平衡,氢氧根离子浓度增大;
(3)甲池是精炼铜,增重12.8g是铜的质量,根据电解反应过程中电极上的电子守恒计算;
(4)依据析出铜的物质的量结合电子守恒计算生成的氢氧化钠的物质的量,来计算浓度;
(1)依据电解原理精炼铜的装置是粗铜做阳极,精铜做阴极;含铜离子的溶液做电解质溶液;
(2)乙池中是电解饱和食盐水,溶液中的氢离子在阴极得到电子发生还原反应生成氢气,破坏了水的电离平衡,氢氧根离子浓度增大;
(3)甲池是精炼铜,增重12.8g是铜的质量,根据电解反应过程中电极上的电子守恒计算;
(4)依据析出铜的物质的量结合电子守恒计算生成的氢氧化钠的物质的量,来计算浓度;
解答:解:图示是两个串联的电解池,依据电源判断A为阴极,B为阳极,Fe为阴极,C为阳极;
(1)依据电解原理精炼铜的装置是粗铜做阳极,精铜做阴极;含铜离子的溶液做电解质溶液;所以A极是阴极;材料是精铜;电极反应为:Cu2++2e-=Cu;B为阳极;材料是粗铜;电极反应主要为:Cu-2e-=Cu2+;电解质溶液是CuSO4溶液;
故答案为:阴极,精铜,Cu2++2e-=Cu;阳极,粗铜,Cu-2e-=Cu2+;CuSO4溶液;
(2)乙池中是电解饱和食盐水,溶液中的氢离子在阴极得到电子发生还原反应生成氢气,破坏了水的电离平衡,氢氧根离子浓度增大,遇酚酞变红;是Fe电极附近变红;
故答案为:Fe;
(3)甲池是精炼铜,增重12.8g是铜的质量,物质的量为0.2mol,转移电子物质的量为0.4mol;根据电解反应过程中电极上的电子守恒计算可知;乙槽阳极电极反应为:2Cl--2e-=Cl2↑放出气体物质的量为0.2mol;在标准状况下的体积为4.48L;
故答案为:4.48L;
(4)依据析出铜的物质的量为0.2mol,电子转移为0.4mol,结合电子守恒和水电离出的氢离子和氢氧根离子守恒计算生成的氢氧化钠的物质的量来计算浓度;电极反应为:2H++2e-=H2↑;减少氢离子物质的量为0.4mol,溶液中增多氢氧根离子物质的量为0.4mol,常温下若乙槽剩余液体为400mL,则电解后得到碱液的物质的量浓度为1mol/L;
故答案为:1mol/L
(1)依据电解原理精炼铜的装置是粗铜做阳极,精铜做阴极;含铜离子的溶液做电解质溶液;所以A极是阴极;材料是精铜;电极反应为:Cu2++2e-=Cu;B为阳极;材料是粗铜;电极反应主要为:Cu-2e-=Cu2+;电解质溶液是CuSO4溶液;
故答案为:阴极,精铜,Cu2++2e-=Cu;阳极,粗铜,Cu-2e-=Cu2+;CuSO4溶液;
(2)乙池中是电解饱和食盐水,溶液中的氢离子在阴极得到电子发生还原反应生成氢气,破坏了水的电离平衡,氢氧根离子浓度增大,遇酚酞变红;是Fe电极附近变红;
故答案为:Fe;
(3)甲池是精炼铜,增重12.8g是铜的质量,物质的量为0.2mol,转移电子物质的量为0.4mol;根据电解反应过程中电极上的电子守恒计算可知;乙槽阳极电极反应为:2Cl--2e-=Cl2↑放出气体物质的量为0.2mol;在标准状况下的体积为4.48L;
故答案为:4.48L;
(4)依据析出铜的物质的量为0.2mol,电子转移为0.4mol,结合电子守恒和水电离出的氢离子和氢氧根离子守恒计算生成的氢氧化钠的物质的量来计算浓度;电极反应为:2H++2e-=H2↑;减少氢离子物质的量为0.4mol,溶液中增多氢氧根离子物质的量为0.4mol,常温下若乙槽剩余液体为400mL,则电解后得到碱液的物质的量浓度为1mol/L;
故答案为:1mol/L
点评:本题考查了电解池的工作原理的应用,电极判断方法,电极反应的书写,电子守恒的计算应用,串联的电解池,电极的分析判断,电路中电子守恒是解题关键.

练习册系列答案
相关题目
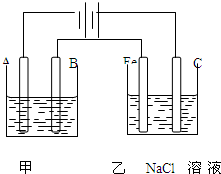 如图为相互串联的甲乙两个电解池,请回答:
如图为相互串联的甲乙两个电解池,请回答: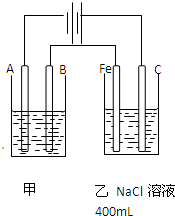 如图为相互串联的甲乙两个电解池,请回答:
如图为相互串联的甲乙两个电解池,请回答: