摘要:21.A.B.C.D四种短周期元素分别处于两个族中.两族序数之和为10.它们彼此之间能形成AD.BD2等三种化合物.以此推断这三种化合物的化学式分别是 . . .晶体类型分别属于 . . .它们之中的 既不与碱反应.又不与酸反应.
网址:http://m.1010jiajiao.com/timu3_id_338840[举报]
 A、B、C、D四种短周期元素,A、B、C同周期,A的原子半径是同周期中最大的;B、D同主族.己知D元素的一种单质是日常生活中饮水机常用的消毒剂,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质.
A、B、C、D四种短周期元素,A、B、C同周期,A的原子半径是同周期中最大的;B、D同主族.己知D元素的一种单质是日常生活中饮水机常用的消毒剂,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质.(1)C元素在周期表中的位置
第三周期、第 VIIA族
第三周期、第 VIIA族
.(2)A元素与水反应的离子方程式是
2Na+2H2O=2Na++2OH-+H2↑
2Na+2H2O=2Na++2OH-+H2↑
.(3)写出C元素的单质从A、B两元素组成的化合物的水溶液中置换出B元素的单质的化学方程式
Cl2+Na2S=2NaCl+S↓
Cl2+Na2S=2NaCl+S↓
.(4)BD2和C2均具有漂白性,二者的漂白原理
不同
不同
.(填“相同”或“不同”)(5)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:3H2+N2
 2NH3△H=-92.4kJ?mol-1
2NH3△H=-92.4kJ?mol-1①当合成氨反应达到平衡后,改变某一外界条件 (不改变N2、H2和NH3的量),反应速率与时间的关系如图所示.图中t1时引起平衡移动的条件可能是
加压
加压
,其中表示平衡混合物中NH3的含量最高的一段时间是t2-t3
t2-t3
.②温度为T℃时,将2a molH2和a molN2放入0.5L 密闭容器中,充分反应后测得N2的转化率为50%.则该反应的平衡常数为
| 4 |
| a2 |
| 4 |
| a2 |
A、B、C、D四种短周期元素原子序数依次增大,A元素原子的价电子排列为ns2np2,B元素的最外层电子数是其电子层数的3倍,E元素原子的价电子排布为3d64s2.C、D的电离能数据如下(kJ?mol-1):
(1)化合价是元素的一种性质.由C、D的电离能数据判断,C通常显
(2)某单质甲分子与化合物AB分子中电子总数相等,则甲分子中包含
(3)AB的总键能大于甲的总键能,但AB比甲容易参加化学反应.根据下表数据,说明AB比甲活泼的原因是
 (4)E能与AB形成配合物,其中E提供
(4)E能与AB形成配合物,其中E提供
(5)如图所示晶胞中,阳离子与阴离子的个数为
查看习题详情和答案>>
| I1 | I2 | I3 | I4 | |
| C | 738 | 1451 | 7733 | 10540 |
| D | 577 | 1817 | 2745 | 11578 |
+2
+2
价,D显+3
+3
价;(2)某单质甲分子与化合物AB分子中电子总数相等,则甲分子中包含
1
1
个σ键,2
2
个π键;(3)AB的总键能大于甲的总键能,但AB比甲容易参加化学反应.根据下表数据,说明AB比甲活泼的原因是
断裂C≡O中的一个π键消耗的能量是273kJ/mol,断裂N≡N中的一个π键消耗的能量是523.3kJ/mol,断裂一个π键CO比N2更容易,所以CO更活泼
断裂C≡O中的一个π键消耗的能量是273kJ/mol,断裂N≡N中的一个π键消耗的能量是523.3kJ/mol,断裂一个π键CO比N2更容易,所以CO更活泼
.| 单键 | 双键 | 叁键 | ||
| AB | 键能(kJ?mol-1) | 357.7 | 798.9 | 1071.9 |
| 甲 | 键能(kJ?mol-1) | 154.8 | 418.4 | 941.7 |
 (4)E能与AB形成配合物,其中E提供
(4)E能与AB形成配合物,其中E提供空轨道
空轨道
,AB提供孤对电子
孤对电子
.(5)如图所示晶胞中,阳离子与阴离子的个数为
3:1
3:1
.A、B、C、D四种短周期元素,原子序数依次增大,离子半径依次减小,A与C可形成原子个数比分别为1:1和1:2的两种离子化合物,A与D的原子序数之和等于B与C的原子序数之和,请回答下列问题.
(1)写出元素符号:B
(2)A、C形成的离子化合物与CO2发生氧化还原反应的化学方程式:
(3)B、C形成的化合物溶于水时,溶液中所有离子的物质的量浓度由大到小的顺序为
查看习题详情和答案>>
(1)写出元素符号:B
F
F
,DMg
Mg
.(2)A、C形成的离子化合物与CO2发生氧化还原反应的化学方程式:
2Na2O2+2CO2═2Na2CO3+O2
2Na2O2+2CO2═2Na2CO3+O2
.(3)B、C形成的化合物溶于水时,溶液中所有离子的物质的量浓度由大到小的顺序为
c(Na+)>c(F-)>c(OH-)>c(H+)
c(Na+)>c(F-)>c(OH-)>c(H+)
.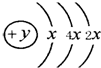 A、B、C、D四种短周期元素,且A、B、D为相邻的同周期元素,C、B同主族,B、C可形成共价化合物BC3和BC2,A的原子结构示意图,据此填空:
A、B、C、D四种短周期元素,且A、B、D为相邻的同周期元素,C、B同主族,B、C可形成共价化合物BC3和BC2,A的原子结构示意图,据此填空:(1)A的元素名称为
硅
硅
,其气态氢化物的化学式为SiH4
SiH4
.(2)A、B、C、D种元素的原子,半径由小到大的顺序为
O<S<P<Si
O<S<P<Si
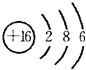
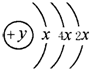
.(3)分别画出B和D的原子结构示意图为



 A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图如图,B元素最外层电子数是次外层电子数的四分之一,C元素的气态氢化物的水溶液显碱性,据此填空:
A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图如图,B元素最外层电子数是次外层电子数的四分之一,C元素的气态氢化物的水溶液显碱性,据此填空:(1)A元素气态氢化物的电子式
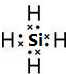
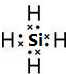
Mg>Si>P>N
Mg>Si>P>N
.(填元素符号)(2)A的最高价氧化物与氢氧化钠反应的离子方程式为
SiO2+2OH-=SiO32-+H2O
SiO2+2OH-=SiO32-+H2O
.(3)A,C,D的最高价氧化物对应水化物的酸性强弱
HNO3>H2SiO3>H3PO4
HNO3>H2SiO3>H3PO4
C的氢化物比D的氢化物沸点高
高
(填“高”或“低”),原因是NH3分子之间存在氢键,故其沸点比PH3的沸点高
NH3分子之间存在氢键,故其沸点比PH3的沸点高
.