题目内容
A、B、C、D四种短周期元素,原子序数依次增大,离子半径依次减小,A与C可形成原子个数比分别为1:1和1:2的两种离子化合物,A与D的原子序数之和等于B与C的原子序数之和,请回答下列问题.
(1)写出元素符号:B
(2)A、C形成的离子化合物与CO2发生氧化还原反应的化学方程式:
(3)B、C形成的化合物溶于水时,溶液中所有离子的物质的量浓度由大到小的顺序为
(1)写出元素符号:B
F
F
,DMg
Mg
.(2)A、C形成的离子化合物与CO2发生氧化还原反应的化学方程式:
2Na2O2+2CO2═2Na2CO3+O2
2Na2O2+2CO2═2Na2CO3+O2
.(3)B、C形成的化合物溶于水时,溶液中所有离子的物质的量浓度由大到小的顺序为
c(Na+)>c(F-)>c(OH-)>c(H+)
c(Na+)>c(F-)>c(OH-)>c(H+)
.分析:A、C能形成1:1和1:2两种离子化合物故:A为O,C为Na.A、B、C、D原子序数增大,而离子半径依次减小,推知可能为电子层结构相同的离子.A形成O2-,C形成Na+,D可能形成Mg2+、Al3+.又知A、D原子序数之和等于B、C原子序数之和,故D为Mg,B为F,结合物质的性质分析解答.
解答:解:A、C能形成1:1和1:2两种离子化合物故:A为O,C为Na.A、B、C、D原子序数增大,而离子半径依次减小,推知可能为电子层结构相同的离子.A形成O2-,C形成Na+,D可能形成Mg2+、Al3+.又知A、D原子序数之和等于B、C原子序数之和,故D为Mg,B为F.
(1)通过以上分析知,B是F元素,D是Mg元素,故答案为:F;Mg;
(2)A、C形成的离子化合物能和二氧化碳发生氧化还原反应,则该离子化合物是Na2O2,过氧化钠和二氧化碳反应生成碳酸钠和氧气,反应方程式为:2Na2O2+2CO2═2Na2CO3+O2,故答案为:2Na2O2+2CO2═2Na2CO3+O2;
(3)B、C形成的化合物是NaF,氟化钠是强碱弱酸盐,氟离子易水解而使其溶液呈碱性,则c(OH-)>c(H+),溶液中存在电荷守恒c(OH-)+c(F-)=c(H+)+c(Na+),所以c(Na+)>c(F-),氟离子水解较微弱,所以c(F-)>c(OH-),则离子浓度大小顺序是c(Na+)>c(F-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(F-)>c(OH-)>c(H+).
(1)通过以上分析知,B是F元素,D是Mg元素,故答案为:F;Mg;
(2)A、C形成的离子化合物能和二氧化碳发生氧化还原反应,则该离子化合物是Na2O2,过氧化钠和二氧化碳反应生成碳酸钠和氧气,反应方程式为:2Na2O2+2CO2═2Na2CO3+O2,故答案为:2Na2O2+2CO2═2Na2CO3+O2;
(3)B、C形成的化合物是NaF,氟化钠是强碱弱酸盐,氟离子易水解而使其溶液呈碱性,则c(OH-)>c(H+),溶液中存在电荷守恒c(OH-)+c(F-)=c(H+)+c(Na+),所以c(Na+)>c(F-),氟离子水解较微弱,所以c(F-)>c(OH-),则离子浓度大小顺序是c(Na+)>c(F-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(F-)>c(OH-)>c(H+).
点评:本题考查了原子结构和元素的性质,正确推断元素是解本题关键,根据离子半径大小、原子序数相对大小来分析判断,结合电荷守恒来解答问题,难度中等.

练习册系列答案
相关题目
A、B、C、D四种短周期元素的原子半径依次减小,A与C的核电荷数之比3:4,D分别与A、B、C可形成10个电子的分子X、Y、Z.则下列叙述正确的是( )
| A、X、Y、Z三种分子的稳定性逐渐减弱 | B、上述四种元素共能形成五种单质 | C、X、Y、Z三种分子的沸点逐渐升高 | D、X、Y、Z三种分子均为极性分子 |

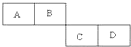 A、B、C、D四种短周期元素在周期表中的相对位置如表所示,A的单质与水蒸气反应可以制取水煤气.
A、B、C、D四种短周期元素在周期表中的相对位置如表所示,A的单质与水蒸气反应可以制取水煤气.