摘要:油酸的摩尔质量为M.密度为ρ.一滴油酸的质量为m.它在液面上扩散后的最大面积为S.已知阿伏加德罗常数为NA.下面是四种表达式: ①油酸分子的直径 ②油酸分子的直径 ③油滴所含的分子数 ④油滴所含的分子数 其中正确的是 A.①③ B.②③ C.①④ D.②④
网址:http://m.1010jiajiao.com/timu3_id_334014[举报]
现有某XY3气体m g,它的摩尔质量为M g?mol-1.若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为
mol
mol
(2)该气体所含原子总数为
个
(3)该气体在标准状况下的体积为
L
L
(4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为
%
%
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为
mol/L
mol/L;将该溶液加水稀释至原体积的2倍后,再取出50mL稀释后的溶液,则取出溶液的物质的量浓度为
mol/L
mol/L
(6)标准状况下,相同体积的另一种气体CH4含有氢原子的物质的量为
mol
mol.
查看习题详情和答案>>
(1)该气体的物质的量为
| m |
| M |
| m |
| M |
(2)该气体所含原子总数为
| 4mNA |
| M |
| 4mNA |
| M |
(3)该气体在标准状况下的体积为
| 22.4m |
| M |
| 22.4m |
| M |
(4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为
| 100m |
| (1000+m) |
| 100m |
| (1000+m) |
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为
| m |
| MV |
| m |
| MV |
| m |
| 2MV |
| m |
| 2MV |
(6)标准状况下,相同体积的另一种气体CH4含有氢原子的物质的量为
| 4m |
| M |
| 4m |
| M |
(1)①写出NaHSO4在水溶液中的电离方程式
②CO2通入足量氢氧化钠溶液反应的离子反应方程式
③OH-+H+=H2O改写为化学方程式
Cu2++Fe=Fe2++Cu改写为化学方程式
(2)①同温同压下,某瓶充满氧气时质量为116g,充满二氧化碳时,质量为122g,充满气体A时质量为114g,A的摩尔质量为
②现有m g某气体,它由双原子分子构成,它的摩尔质量为M g/mol.若阿伏加德罗常数用NA表示,则该气体所含原子总数为
个.
(3)下列实验操作中不正确的是
A.用分液的方法分离水和汽油的混合物 B.用过滤的方法分离饱和食盐水与沙子的混合物
C.蒸馏时,应使温度计水银球插入液面以下 D.蒸发结晶时应将溶液蒸干后再停止加热
E.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出.
查看习题详情和答案>>
NaHSO4=Na++H++SO42-
NaHSO4=Na++H++SO42-
.②CO2通入足量氢氧化钠溶液反应的离子反应方程式
CO2+2OH-=CO32-+H2O
CO2+2OH-=CO32-+H2O
.③OH-+H+=H2O改写为化学方程式
H2SO4+2NaOH=2H2O+Na2SO4
H2SO4+2NaOH=2H2O+Na2SO4
.Cu2++Fe=Fe2++Cu改写为化学方程式
CuCl2+Fe=FeCl2+Cu
CuCl2+Fe=FeCl2+Cu
.(2)①同温同压下,某瓶充满氧气时质量为116g,充满二氧化碳时,质量为122g,充满气体A时质量为114g,A的摩尔质量为
28g/mol
28g/mol
.②现有m g某气体,它由双原子分子构成,它的摩尔质量为M g/mol.若阿伏加德罗常数用NA表示,则该气体所含原子总数为
| 2mNA |
| M |
| 2mNA |
| M |
(3)下列实验操作中不正确的是
CD
CD
(多选).A.用分液的方法分离水和汽油的混合物 B.用过滤的方法分离饱和食盐水与沙子的混合物
C.蒸馏时,应使温度计水银球插入液面以下 D.蒸发结晶时应将溶液蒸干后再停止加热
E.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出.
(1)现有mg某气体,它由双原子分子构成,它的摩尔质量为M g.mol-1.则:
①该气体的物质的量为
mol.
②该气体所含原子数为
个.
③该气体在标况下的体积为
L.
④该气体溶于水后形成VL溶液,其溶液的物质的量浓度为
mol.L-1.
(2)将40mL 0.5mol/L Na2CO3溶液加水稀释到250mL,求所得溶液中Na+的物质的量浓度.
查看习题详情和答案>>
①该气体的物质的量为
| m |
| M |
| m |
| M |
②该气体所含原子数为
| 2m?NA |
| M |
| 2m?NA |
| M |
③该气体在标况下的体积为
| 22.4m |
| M |
| 22.4m |
| M |
④该气体溶于水后形成VL溶液,其溶液的物质的量浓度为
| m |
| M?L |
| m |
| M?L |
(2)将40mL 0.5mol/L Na2CO3溶液加水稀释到250mL,求所得溶液中Na+的物质的量浓度.
某离子晶体晶胞结构如图所示,x位于立方体的顶点,Y位于立方体中心.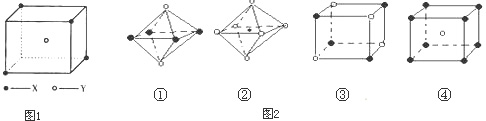
试分析:
(1)晶体中每个Y同时吸引着
(2)晶体中在每个X周围与它最接近且距离相等的X共有
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX的度数为
(4)设该晶体的摩尔质量为M g?mol-1,晶体密度为ρ?cm-3,阿伏加德罗常数为NA则晶体中两个距离最近的X中心间的距离为
cm
cm.
(5)如图2图象是从NaCl或CsCl晶体结构图中分割出来的部分结构图,试判断NaCl晶体结构的图象是
A.①B.②C.③D.④
(6)用价层电子对互斥理论(VSEPR)判断下列分子或离子的空间构型
查看习题详情和答案>>

试分析:
(1)晶体中每个Y同时吸引着
4
4
个X,该晶体的化学式为XY2或Y2X
XY2或Y2X
.(2)晶体中在每个X周围与它最接近且距离相等的X共有
12
12
个.(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX的度数为
109°28′
109°28′
.(4)设该晶体的摩尔质量为M g?mol-1,晶体密度为ρ?cm-3,阿伏加德罗常数为NA则晶体中两个距离最近的X中心间的距离为
| 3 |
| ||
| 2 |
| 3 |
| ||
| 2 |
(5)如图2图象是从NaCl或CsCl晶体结构图中分割出来的部分结构图,试判断NaCl晶体结构的图象是
B
B
A.①B.②C.③D.④
(6)用价层电子对互斥理论(VSEPR)判断下列分子或离子的空间构型
| 分子或离子 | H2S | CO32- | PH3 | ClO4-- |
| 空间构型 | V型 V型 |
平面三角形 平面三角形 |
三角锥型 三角锥型 |
正四面体 正四面体 |