题目内容
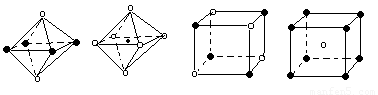
某离子晶体晶胞结构如图所示,x位于立方体的顶点,Y位于立方体中心.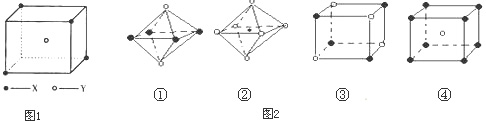
试分析:
(1)晶体中每个Y同时吸引着
(2)晶体中在每个X周围与它最接近且距离相等的X共有
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX的度数为
(4)设该晶体的摩尔质量为M g?mol-1,晶体密度为ρ?cm-3,阿伏加德罗常数为NA则晶体中两个距离最近的X中心间的距离为
cm
cm.
(5)如图2图象是从NaCl或CsCl晶体结构图中分割出来的部分结构图,试判断NaCl晶体结构的图象是
A.①B.②C.③D.④
(6)用价层电子对互斥理论(VSEPR)判断下列分子或离子的空间构型

试分析:
(1)晶体中每个Y同时吸引着
4
4
个X,该晶体的化学式为XY2或Y2X
XY2或Y2X
.(2)晶体中在每个X周围与它最接近且距离相等的X共有
12
12
个.(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX的度数为
109°28′
109°28′
.(4)设该晶体的摩尔质量为M g?mol-1,晶体密度为ρ?cm-3,阿伏加德罗常数为NA则晶体中两个距离最近的X中心间的距离为
| 3 |
| ||
| 2 |
| 3 |
| ||
| 2 |
(5)如图2图象是从NaCl或CsCl晶体结构图中分割出来的部分结构图,试判断NaCl晶体结构的图象是
B
B
A.①B.②C.③D.④
(6)用价层电子对互斥理论(VSEPR)判断下列分子或离子的空间构型
| 分子或离子 | H2S | CO32- | PH3 | ClO4-- |
| 空间构型 | V型 V型 |
平面三角形 平面三角形 |
三角锥型 三角锥型 |
正四面体 正四面体 |
分析:(1)根据图片方向并利用均摊法确定其化学式;
(2)晶体中在每个X周围与它最接近且距离相等的X有3×8×
=12;
(3)由离子晶体晶胞图,X位于立方体的顶点,Y位于立方体中心,则1个晶胞中含X为4×
=
,含Y为1,X、Y的离子个数之比为1:2,1个Y与4个X形成空间正四面体结构;
(4)设两个距离最近的X中心间的距离为xcm,则晶胞的体积=
x3cm3,再结合ρ=
进行解答.
(5)根据氯化钠晶体中钠离子或氯离子的配位数判断其结构图是否正确,钠离子或氯离子的配位数都是6;
(6)根据价层电子对互斥理论确定其空间构型;
(2)晶体中在每个X周围与它最接近且距离相等的X有3×8×
| 1 |
| 2 |
(3)由离子晶体晶胞图,X位于立方体的顶点,Y位于立方体中心,则1个晶胞中含X为4×
| 1 |
| 8 |
| 1 |
| 2 |
(4)设两个距离最近的X中心间的距离为xcm,则晶胞的体积=
| ||
| 2 |
| ||||
| V |
(5)根据氯化钠晶体中钠离子或氯离子的配位数判断其结构图是否正确,钠离子或氯离子的配位数都是6;
(6)根据价层电子对互斥理论确定其空间构型;
解答:解:(1)由离子晶体晶胞图,X位于立方体的顶点,Y位于立方体中心,则每个Y同时吸引着4个X,空间有8个晶胞无隙并置,则每个X同时吸引着8个Y,1个晶胞中含X为4×
=
,含Y为1,X、Y的离子个数之比为1:2,则晶体的化学式为XY2或Y2X,
故答案为:4;XY2或Y2X;
(2)由图可知,X在顶点,则一个晶胞中最近的X有3个,为面上的距离,晶体中在每个X周围与它最接近且距离相等的X共有3×8×
=12,
故答案为:12;
(3)1个Y与4个X形成空间正四面体结构,则晶体中距离最近的2个X与1个Y形成的夹角∠XYX的度数为109°28′,
故答案为:109°28′;
(4)设两个距离最近的X中心间的距离为xcm,则晶胞的体积=
x3cm3,ρ=
,
则x=
cm=
cm,
故答案为:
cm;
(5)由于在NaCl晶体中,每个Na+周围同时吸引着最近的等距离的6个Cl-同样每个Cl-周围同时吸引着最近的等距离的6个Na+,钠离子和氯离子的配位数是6,
故选:B;
(6)硫化氢分子中硫原子含有两个共价单键且含有两个孤电子对,所以为V形结构;
碳酸根离子价层电子对个数是3+
(4+2-3×2)=3,且不含孤电子对,所以为平面三角形结构;
磷化氢分子中价层电子对个数=3+
(5-3×1)=4,且含有一个孤电子对,所以为三角锥型结构;
高氯酸根离子中价层电子对个数=4+
(7+1-4×2)=4,且不含孤电子对,为正四面体结构,
故答案为:V形,平面三角形,三角锥形,正四面体.
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:4;XY2或Y2X;
(2)由图可知,X在顶点,则一个晶胞中最近的X有3个,为面上的距离,晶体中在每个X周围与它最接近且距离相等的X共有3×8×
| 1 |
| 2 |
故答案为:12;
(3)1个Y与4个X形成空间正四面体结构,则晶体中距离最近的2个X与1个Y形成的夹角∠XYX的度数为109°28′,
故答案为:109°28′;
(4)设两个距离最近的X中心间的距离为xcm,则晶胞的体积=
| ||
| 2 |
| ||||
| V |
则x=
| 3 |
| ||||||||||
| 3 |
| ||
| 2 |
故答案为:
| 3 |
| ||
| 2 |
(5)由于在NaCl晶体中,每个Na+周围同时吸引着最近的等距离的6个Cl-同样每个Cl-周围同时吸引着最近的等距离的6个Na+,钠离子和氯离子的配位数是6,
故选:B;
(6)硫化氢分子中硫原子含有两个共价单键且含有两个孤电子对,所以为V形结构;
碳酸根离子价层电子对个数是3+
| 1 |
| 2 |
磷化氢分子中价层电子对个数=3+
| 1 |
| 2 |
高氯酸根离子中价层电子对个数=4+
| 1 |
| 2 |
故答案为:V形,平面三角形,三角锥形,正四面体.
点评:本题考查了晶胞的计算、粒子空间构型的判断,利用均摊法确定化学式,根据价层电子对互斥理论确定粒子空间构型,难点是计算(4)中两个距离最近的X中心间的距离,根据公式来推导,难度较大.

练习册系列答案
相关题目
 某离子晶体晶胞结构如图所示,X位于立方体的顶点,Y位于立方体中心.试分析:
某离子晶体晶胞结构如图所示,X位于立方体的顶点,Y位于立方体中心.试分析: 某离子晶体晶胞结构如图所示,x位于立方体的顶点,Y位于立方体中心.试分析:每个x同时吸引着
某离子晶体晶胞结构如图所示,x位于立方体的顶点,Y位于立方体中心.试分析:每个x同时吸引着 某离子晶体晶胞结构如图所示,x位于立方体的顶点,Y位于立方体中心.试分析:
某离子晶体晶胞结构如图所示,x位于立方体的顶点,Y位于立方体中心.试分析: