题目内容
下表为元素周期表的一部分,a、b、c…为部分元素.回答下列问题:
(1)请写出上述元素d3+的核外电子排布式
(2)请写出e元素的原子电子轨道表示式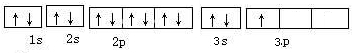
 ;
;
(3)ya3分子的电子式是
 ,其分子的空间构型是
,其分子的空间构型是
(4)b、e两种元素中,金属性较强的是
(5)h的i形成hi2分子杂化类型是
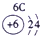
| a | |||||||||||||||||
| f | y | h | i | ||||||||||||||
| b | e | j | |||||||||||||||
| c | d | d | g | l | |||||||||||||
1s222s2p63s23p63d5
1s222s2p63s23p63d5
;(2)请写出e元素的原子电子轨道表示式


(3)ya3分子的电子式是


三角锥形
三角锥形
,(4)b、e两种元素中,金属性较强的是
Mg
Mg
;第一电离能大的是Mg
Mg
.(填元素符号)(5)h的i形成hi2分子杂化类型是
sp3
sp3
fh32-的空间构型分别为平面正三角形
平面正三角形
.分析:(1)由元素在周期表中的位置可知,d为Fe元素,原子序数为26;
(2)由元素在周期表中的位置可知,e为Al元素,原子序数为13;
(3)y为N,a为H,则ya3分子为NH3,由最外层电子等来分析;
(4)b为Mg,e为Al,Mg、Al均在第三周期,同周期从左向右金属性减弱,金属性越强,第一电离能越小,但镁原子最外层为全满;
(5)h为O,i为F,f为C,利用最外层电子及成键来分析杂化及空间构型.
(2)由元素在周期表中的位置可知,e为Al元素,原子序数为13;
(3)y为N,a为H,则ya3分子为NH3,由最外层电子等来分析;
(4)b为Mg,e为Al,Mg、Al均在第三周期,同周期从左向右金属性减弱,金属性越强,第一电离能越小,但镁原子最外层为全满;
(5)h为O,i为F,f为C,利用最外层电子及成键来分析杂化及空间构型.
解答:解:(1)由元素在周期表中的位置可知,d为Fe元素,原子序数为26,则Fe3+的核外电子排布式的1s222s2p63s23p63d5,故答案为:1s222s2p63s23p63d5;
(2)e为Al元素,原子序数为13,其电子轨道表示式为 ,
,
故答案为: ;
;
(3)y为N,a为H,则ya3分子为NH3,其电子式为 ,空间构型为三角锥形,故答案为:
,空间构型为三角锥形,故答案为: ;三角锥形;
;三角锥形;
(4)b为Mg,e为Al,金属性Mg>Al,镁原子最外层为全满,失去1个电子较难,则第一电离能大,故答案为:Mg;Mg;
(5)h为O,i为F,f为C,OF2分子中O原子上有2对孤电子对,σ键数为2,则杂化类型sp3,CO32-中无孤电子对,σ键数为3,则杂化类型sp2,则空间构型为平面正三角形,
故答案为:sp3;平面正三角形.
(2)e为Al元素,原子序数为13,其电子轨道表示式为
 ,
,故答案为:
 ;
;(3)y为N,a为H,则ya3分子为NH3,其电子式为
 ,空间构型为三角锥形,故答案为:
,空间构型为三角锥形,故答案为: ;三角锥形;
;三角锥形;(4)b为Mg,e为Al,金属性Mg>Al,镁原子最外层为全满,失去1个电子较难,则第一电离能大,故答案为:Mg;Mg;
(5)h为O,i为F,f为C,OF2分子中O原子上有2对孤电子对,σ键数为2,则杂化类型sp3,CO32-中无孤电子对,σ键数为3,则杂化类型sp2,则空间构型为平面正三角形,
故答案为:sp3;平面正三角形.
点评:本题考查元素周期表和元素周期律的综合应用,明确元素在周期表中的位置是解答本题的关键,然后利用物质结构及其性质来解答即可,难度不大.

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目








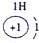
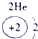
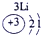
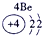
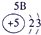
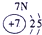
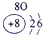
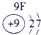
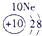
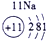





 表示的是
表示的是