摘要: 与50mL0.5mol/L (NH4)2SO4 溶液中c(NH4+)相同的是 A.100 mL 1 mol/L NH3 ·H2O 溶液 B.200 mL 0.5 mol/L NH4Cl 溶液 C.50 mL 0.5 mol/L CH3COONH4 溶液 D.200 mL 1 mol/L NH4NO3 溶液
网址:http://m.1010jiajiao.com/timu3_id_319250[举报]
用右图所示装置进行中和热测定实验,请回答问题:
(1)大小烧杯之间填满碎泡沫塑料的作用是
(2)使用补全仪器后的装置进行实验,取50mL0.25mol/LH2SO4溶液与50mL0.55mol/LNaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高3.4℃.已知中和后生成的溶液的比热容为4.18J/(g?℃),溶液的密度均为1g/cm3.通过计算可得中和热△H=
H2SO4(aq)+NaOH(aq)=Na2SO4(aq)+H2O(l),△H=-56.8KJ/mol
H2SO4(aq)+NaOH(aq)=Na2SO4(aq)+H2O(l),△H=-56.8KJ/mol.
(3)实验中若用60mL0.25mol?L-1H2SO4溶液跟50mL0.55mol?L-1NaOH溶液进行反应,与上述实验相比,所放出的热量
查看习题详情和答案>>
(1)大小烧杯之间填满碎泡沫塑料的作用是
保温、隔热、减少实验过程中的热量散失
保温、隔热、减少实验过程中的热量散失
,从实验装置上看,图中缺少的一种玻璃仪器是环形玻璃搅拌器
环形玻璃搅拌器
.(2)使用补全仪器后的装置进行实验,取50mL0.25mol/LH2SO4溶液与50mL0.55mol/LNaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高3.4℃.已知中和后生成的溶液的比热容为4.18J/(g?℃),溶液的密度均为1g/cm3.通过计算可得中和热△H=
-56.8KJ/mol
-56.8KJ/mol
,H2SO4与NaOH反应的热化学方程式为| 1 |
| 2 |
| 1 |
| 2 |
(3)实验中若用60mL0.25mol?L-1H2SO4溶液跟50mL0.55mol?L-1NaOH溶液进行反应,与上述实验相比,所放出的热量
不相等
不相等
(填“相等”、“不相等”),所求中和热相等
相等
(填“相等”、“不相等”);,若用50mL0.50mol?L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会偏小
偏小
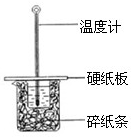
(填“偏大”、“偏小”、“不受影响”).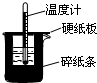 50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)从实验装置看,图中尚缺少的一种玻璃用品是
(2)烧杯间填满碎纸条的作用是
(3)实验中改用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比较,所放出的热量
(4)用50mL0.50mol/L的醋酸代替盐酸溶液进行上述实验,测得中和热的数值与57.3kJ/mol相比较会
(5)完整地做一次这样的实验,需测定
(6)大烧杯上如不盖硬纸板,求得的中和热数值
 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)从实验装置上看,图中尚缺少的一种玻璃仪器是
环形玻璃搅拌棒
环形玻璃搅拌棒
.(2)烧杯间填满碎纸条的作用是
减少实验过程中的热量损失
减少实验过程中的热量损失
.(3)要重复进行三次实验的目的是
多次测量求平均值可以减少实验误差
多次测量求平均值可以减少实验误差
.(4)大烧杯上如不盖硬纸板,求得的中和热数值
偏小
偏小
(填“偏大、偏小、无影响”);当室温低于10℃时进行,对实验结果会造成较大的误差,其原因是室温较低时反应体系向环境散热比较快,热量损失大,结果偏低
室温较低时反应体系向环境散热比较快,热量损失大,结果偏低
(5)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量
不相等
不相等
(填“相等、不相等”),所求中和热相等
相等
(填“相等、不相等”),简述理由因为中和热是指酸跟碱发生中和反应生成nmolH2O所放出的热量,与酸碱的用量无关
因为中和热是指酸跟碱发生中和反应生成nmolH2O所放出的热量,与酸碱的用量无关
.(6)用相同浓度和体积的醋酸(CH3COOH)代替HCl溶液进行上述实验,测得的中和热的数值会
偏小
偏小
;(填“偏大、偏小、无影响”).(7)三次平行操作所测得的数据如下:
| 温度 序号 |
起始温度t1/℃ | 终止温度 T2/℃ |
温度差 △t/℃ | ||
| HCl | NaOH | 平均值 | |||
| 1 | 25 | 25 | 27.3 | ||
| 2 | 25 | 25 | 27.4 | ||
| 3 | 25 | 25 | 28.6 | ||
46.3kJ?mol-1
46.3kJ?mol-1
.含有C、H、O的化合物,其C、H、O的质量比为12:1:16,其蒸气相对于氢气的密度为58,它能使甲基橙溶液变红,也能使溴水褪色,0.58g这种物质能与50mL0.2mol/L的氢氧化钠溶液完全反应.试回答:
(1)该有机物中各原子个数比N(C):N(H):N(O)=
(2)该有机物的摩尔质量为
(3)该有机物的可能结构简式有
查看习题详情和答案>>
(1)该有机物中各原子个数比N(C):N(H):N(O)=
1:1:1
1:1:1
(2)该有机物的摩尔质量为
116g/mol
116g/mol
,写出分子式C4H4O4
C4H4O4
(3)该有机物的可能结构简式有
HOOC-CH=CH-COOH或CH2=CH(COOH)2
HOOC-CH=CH-COOH或CH2=CH(COOH)2
. (1)经测定,20g氢气在氧气中燃烧生成水蒸气,放热2418.0kJ,写出该反应的热化学方程式
(1)经测定,20g氢气在氧气中燃烧生成水蒸气,放热2418.0kJ,写出该反应的热化学方程式2H2(g)+O2(g)=2H2O(g)△H=-483.6KJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-483.6KJ/mol
;已知:3Fe (s)+2O2(g)═Fe3O4(s)△H=-1118.4kJ?mol-1,根据以上信息,则反应 3Fe(s)+4H2O(g)═Fe3O4(s)+4H2(g) 的△H=-151.2KJ/mol;
-151.2KJ/mol;
(2)某学生实验小组用50mL0.50mol?L-1的盐酸与50mL0.50mol?L-1的NaOH溶液在右图所示的装置中进行中和反应反应热的测定
①图中装置缺少的一种仪器,该仪器名称为
环形玻璃搅拌器
环形玻璃搅拌器
.②将反应混合液的
最高
最高
温度记为反应的终止温度.③下列说法正确的是
A
A
A.小烧杯内残留有水,会使测得的反应热数值偏小
B.可用相同浓度和体积的醋酸代替稀盐酸溶液进行实验
C.烧杯间填满碎纸条的作用是固定小烧杯
D.酸、碱混合时,应把量筒中的溶液缓缓倒入烧杯的溶液中,以防液体外溅.