摘要:一定条件下.在体积为3L的密闭容器中化学反应CO(g)+2H2(g)CH3OH(g)达到平衡状态. (1)该反应的平衡常数表达式K= , 根据右图.升高温度.K值将 (填“增 大 .“减小 或“不变 ). (2)500℃时.从反应开始到达到化学平衡.以H2的 浓度变化表示的化学反应速率是 (用nB. tB表示) (3)判断该可逆反应达到化学平衡状态的标志是 . a. b.混合气体的密度不再改变 c.混合气体的平均相对分子质量不再改变 d.CO.H2.CH3OH的浓度均不再变化 (4)300℃时.将容器的容积压缩到原来的1/2.在其他条件不变的情况下.对平衡体系产生的影响是 . a.C(H2)减小 b.正反应速率加快.逆反应速率减慢 c.CH3OH物质的量增加 d.重新平衡C(H2)/C(CH3OH)减小
网址:http://m.1010jiajiao.com/timu3_id_314811[举报]
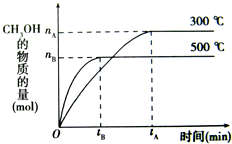 一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g)-CH3OH(g)达到平衡状态.
一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g)-CH3OH(g)达到平衡状态.(1)该反应的平衡常数表达式K=
| c(CH3OH) |
| c(CO)×c2(H2) |
| c(CH3OH) |
| c(CO)×c2(H2) |
增大
增大
(填“增大”、“减小”或“不变”.(2)500℃时,从反应开始到达到平衡状态,以CO的浓度变化表示的化学反应速率是v(CO)=
| nB |
| 3tB |
| nB |
| 3tB |
(3)判断可逆反应达到平衡状态的标志是
cd
cd
(填字母).a.v生成(CH3OH)=v消耗(CO) b.混合气体的密度不再改变
c.容器内气体的压强保持不变 d.CO、H2、CH3OH的浓度不再改变
(4)300℃时,将容器的体积增大1倍,在其他条件不变的情况下,对平衡体系产生的影响是
cd
cd
(填字母).a.c(H2)增大 b.正反应速率减慢,逆反应速率加快
c.CH3OH的物质的量减小 d.重新平衡时c(H2)/c(CH3OH)增大.
 9、一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)
9、一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)
CH3OH(g)根据题意完成下列各题:
(1)在某温度下,反应物的起始浓度分别为:
c(CO)=1mol,L-1,c(H2)=2mol?L-1; 达到平衡后,H2的转化率为60%,平衡常数K=
2.34
2.34
,升高温度,K值减小
减小
(填“增大”、“减小”或“不变”).(2)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
bc
bc
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
(3)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:
Cu2O+CO 2Cu+CO2
2Cu+CO2
 2Cu+CO2
2Cu+CO2Cu2O+CO 2Cu+CO2
2Cu+CO2
(用化学方程式表示). 2Cu+CO2
2Cu+CO2 (4)反应过程中CO(g)、H2(g)、CH3OH(g)物质的量变化如图所示,分别用A、B、C表示CO、H2、CH3OH,根据图中所示判断下列说法正确的是
(4)反应过程中CO(g)、H2(g)、CH3OH(g)物质的量变化如图所示,分别用A、B、C表示CO、H2、CH3OH,根据图中所示判断下列说法正确的是AD
AD
.A.10~15min可能是加入了正催化剂
B.10~15min可能是降低了温度
C.20min时可能是缩小了容器体积
D.20min时可能是增加了B的量.
 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)CH3OH(g)根据题意完成下列各题:
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)CH3OH(g)根据题意完成下列各题:(1)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
| 2n(B) |
| 3t(B) |
| 2n(B) |
| 3t(B) |
(2)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的
| 1 |
| 2 |
bc
bc
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时
| n(H2) |
| n(CH3OH) |
(3)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:
Cu2O+CO?2Cu+CO2
Cu2O+CO?2Cu+CO2
(用化学方程式表示). 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO).根据题意完成下列各题:
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO).根据题意完成下列各题:(1)反应达到平衡时,平衡常数表达式K=
| c(CH3OH) |
| c(CO)c2(H2) |
| c(CH3OH) |
| c(CO)c2(H2) |
减小
减小
(填“增大”“减小”或“不变”).(2)500℃时,从反应开始到平衡,氢气的平均反应速率v(H2)=
| 2nB |
| 3tB |
| 2nB |
| 3tB |
(3)在其他条件不变的情况下,将处于E点的体系的体积压缩到原来的
| 1 |
| 2 |
BC
BC
(填写字母).A.氢气的浓度减少
B.正反应速率加快,逆反应速率也加快
C.甲醇的物质的量增加
D.重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:
Cu2O+CO?2Cu+CO2
Cu2O+CO?2Cu+CO2
(用化学方程式表示). 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g),下列有关说法正确的是( )
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g),下列有关说法正确的是( )