网址:http://m.1010jiajiao.com/timu3_id_300730[举报]
某配位化合物为深蓝色晶体,由原子序数由小到大的A、B、C、D、E五种元素构成,其原子个数比为14:4:5:1:1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+6nsl,回答下列问题。
(1)该配位化合物的化学式为 。元素B、C、D的第一电离能由大到小的排列顺序为_______(用元素符号表示)。
(2)D元素原子的最外层电子排布图为 ,DC42-的立体构型为 。
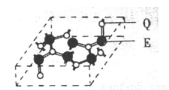
(3)A元素与E元素可形成一种红色化合物,其晶体结构单元如图。
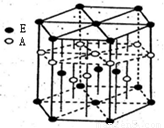
则该化合物的化学式为 ,该化合物可在氯气中燃烧,生成一种棕黄色固体和一种气体,写出该反应的化学方程式 。
查看习题详情和答案>>
某配位化合物为深蓝色晶体,由原子序数由小到大的A、B、C、D、E五种元素构成,其原子个数比为14:4:5:1:1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+6nsl,回答下列问题。
(1)该配位化合物的化学式为____ 。元素B、C、D的第一电离能由大到小的排列顺序为 。 (用元素符号表示)
(2)D元素原子的最外层电子排布图为 。DC42-的立体构型为____ 。
(3)A元素与E元素可形成一种红色化合物,其晶体结构单元如图。则该化合物的化学式为 该化合物可在氯气中燃烧,生成一种棕黄色固体和一种气体,写出该反应的化学方程式 。
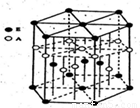
查看习题详情和答案>>
某配位化合物为深蓝色晶体,由原子序数由小到大的A、B、C、D、E五种元素构成,其原子个数比为14:4:5:1:1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+6nsl,回答下列问题。
(1)该配位化合物的化学式为____ 。元素B、C、D的第一电离能由大到小的排列顺序为 。 (用元素符号表示)
(2)D元素原子的最外层电子排布图为 。DC42-的立体构型为____ 。
(3)A元素与E元素可形成一种红色化合物,其晶体结构单元如图。则该化合物的化学式为 该化合物可在氯气中燃烧,生成一种棕黄色固体和一种气体,写出该反应的化学方程式 。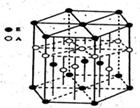
(1)元素B、C、D的第一电离能的由大到小排列顺序为 。(用元素符号表示)
(2)D元素原子的最外层电子排布图为 。
(3)该配位化合物的化学式为 ,配体的中心原子的杂化方式为 。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为 。
(5)A元素与B元素可形成分子式为A2B2的某化合物,该化合物的分子具有平面结构,则其结构式为 ,分子中含有 个s键, 个p键。
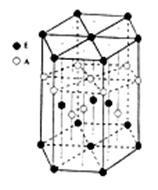
(6)A元素与E元素可形成一种红色化合物,其晶体结构单元如图。则该化合物的 化学式为 。该化合物可在氯气中燃烧,生成一种棕黄色固体和一种气体,写出该反应的化学方程式 。
有E、Q、T、X、Z五种前四周期元素,原子序数E<Q<T<X<Z。E、Q、T三种元素的基态原子具有相同的能层和能级,且I1(E)<I1(T)<I1(Q),其中基态Q原子的2p轨道处于半充满状态,且QT2+与ET2互为等电子体。x为周期表前四周期中电负性最小的元素,Z的原子序数为28。请回答下列问题(答题时如需表示具体元素,请用相应的元素符号):
(1)写出QT2+的电子式 ,基态Z原子的核外电子排布式为 。
(2)Q的简单氢化物极易溶于T的简单氢化物,其主要原因有 (写两条)。
(3)ET2的空间构型为 ,为 分子(填“极性”或“非极性”)
(4)化合物甲由T、X两元素组成,高温下,化合物甲晶体呈立方体结构,其晶胞如图,甲的化学式为 。晶体中氧的化合价部分为0价,部分为-2价,则下列说法正确的是 ( )

A.每个晶胞中含有14个心和13个O2-
B.晶体中每个K+周围有8个O2-,每O2-周围有8个K+
C.晶体中与每个K距离最近的K+有8个
D.晶体中,O价氧原子与-2价氧原子的数目比为3:l
(5)化合物乙的晶胞如图,乙由E、Q两元素组成,硬度超过金刚石。则乙的晶体中E、Q两种元素原子的杂化方式均为 。
查看习题详情和答案>>