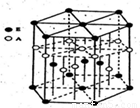
题目内容
某配位化合物为深蓝色晶体,由原子序数由小到大的A、B、C、D、E五种元素构成,其原子个数比为14:4:5:1:1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+6nsl,回答下列问题。
(1)该配位化合物的化学式为 。元素B、C、D的第一电离能由大到小的排列顺序为_______(用元素符号表示)。
(2)D元素原子的最外层电子排布图为 ,DC42-的立体构型为 。
(3)A元素与E元素可形成一种红色化合物,其晶体结构单元如图。
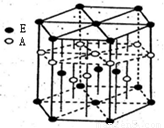
则该化合物的化学式为 ,该化合物可在氯气中燃烧,生成一种棕黄色固体和一种气体,写出该反应的化学方程式 。
【答案】
(1)[Cu(NH3)4]SO4·H2O N>O>S
(2)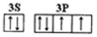 正四面体
正四面体
(3)CuH 2CuH+3Cl2 2CuCl2+2HCl
2CuCl2+2HCl
【解析】
试题分析:C、D元素同主族且原子序数D为C的二倍,所以C为O,D为S,E元素的外围电子排布为(n-l)dn+6nsl,n=4,则外围电子排布为3d104s1,所以A为氢原元素,B为氮元素,C为氧元素,D为硫元素,E为铜元素。所以化学式为[Cu(NH3)4]SO4·H2O;根据同主族电离能的递变规律O>S;由于N的电子排布式为1S22S22P3;为半满结构,所以N的第一电离能比O的第一电离能大。(2)SO42-的立体结构为正四面体。
考点:物质结构

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
 某配位化合物为深蓝色晶体,由原子序数由小到大的A、B、C、D、E五种元素构成,其原子个数比为14:4:5:1:1.其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+6nsl,回答下列问题.
某配位化合物为深蓝色晶体,由原子序数由小到大的A、B、C、D、E五种元素构成,其原子个数比为14:4:5:1:1.其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+6nsl,回答下列问题.