题目内容
某配位化合物为深蓝色晶体,由原子序数由小到大的A、B、C、D、E五种元素构成,其原子个数比为14:4:5:1:1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+6nsl,回答下列问题。
(1)该配位化合物的化学式为____ 。元素B、C、D的第一电离能由大到小的排列顺序为 。 (用元素符号表示)
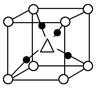
(2)D元素原子的最外层电子排布图为 。DC42-的立体构型为____ 。
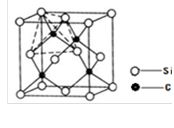
(3)A元素与E元素可形成一种红色化合物,其晶体结构单元如图。则该化合物的化学式为 该化合物可在氯气中燃烧,生成一种棕黄色固体和一种气体,写出该反应的化学方程式 。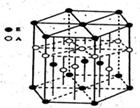
(1)[Cu(NH3)4]SO4·H2O N>O>S;
(2)  正四面体;
正四面体;
(3)CuH 2CuH+3Cl2 2CuCl2+2HCl
2CuCl2+2HCl
解析试题分析:(1) 某配位化合物为深蓝色晶体,由原子序数由小到大的A、B、C、D、E五种元素构成,其原子个数比为14:4:5:1:1。则A、B、C、D、E五种元素分别为H、 N、 O、 S、 CU,所对应的的蓝色晶体为[Cu(NH3)4]SO4·H2O ;O、N属于同一周期元素且原子序数依次减小,同一周期元素的第一电离能随着原子序数的增大而增大,但第ⅤA族的大于第ⅥA族的,所以其第一电离能大小顺序是N、O;O、S属于同一主族元素且原子序数依次增大,同一主族元素的第一电离能随着原子序数的增大而减小,所以第一电离能由大到小:N>O>S;(2)根据能量最低原理和核外电子排布规律,不难写出硫元素核外电子排布图;SO42-中心原子S含有4δ键,孤电子对数为:0,价层电子对数为4,杂化类型为SP3,空间构型为正四面体型。(3)根据均摊法分析,Cu原子:12× +2×
+2× +2=5,H原子:6×
+2=5,H原子:6× +3=5,则该物质化学式为CuH;棕黄色烟为氯化铜固体,无色气体为氯化氢气体,结合反应物和产物不难写出相关化学方程式。
+3=5,则该物质化学式为CuH;棕黄色烟为氯化铜固体,无色气体为氯化氢气体,结合反应物和产物不难写出相关化学方程式。
考点:本题考查较为综合,涉及电子排布式、晶胞计算、电离能以及配合物知识,题目难度中等,注意配合物的分析和积累。

硼和镁形成的化合物刷新了金属化合物超导温度的最高记录。如右图是该化合物的晶体结构单元:镁原子间形成正六棱柱,且棱柱的上下面还各有一个镁原子;6个硼原子位于棱柱的侧棱上,则该化合物的化学式可表示为( )
| A.MgB | B.Mg3B2 |
| C.MgB2 | D.Mg2B3 |
已知下列反应的热化学方程式:6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l) △H1
2 H2(g)+O2(g)=2H2O(g) △H2
C(s)+O2(g)=CO2(g) △H3
则反应4C3H5(ONO2)3(l)=12CO2(g)+10H2O(g)+O2(g)+6N2(g)的△H为( )
| A.12△H3+5△H2-2△H1 | B.2△H1-5△H2-12△H3 |
| C.12△H3-5△H2-2△H1 | D.△H1-5△H2-12△H3 |
已知反应A+B=C+D的能量变化如图所示,下列说法正确的是 ( )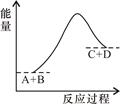
| A.该反应为放热反应 |
| B.该反应为吸热反应 |
| C.反应物的总能量高于生成物的总能量 |
| D.该反应只有在加热条件下才能进行 |
在101kPa 25℃时,1.0g乙烷气体完全燃烧生成液态水时放出热量52.0kJ,则乙烷燃烧的热化学方程式为
A.C2H6(g) + 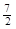 O2(g)=2CO2(g) +3H2O(l)△H =-1560kJ·mol-1 O2(g)=2CO2(g) +3H2O(l)△H =-1560kJ·mol-1 |
| B.2C2H6(g) + 7O2(g)=4CO2(g) +6H2O(g)△H =-1560kJ·mol-1 |
| C.2C2H6(g) + 7O2(g)=4CO2(g) +6H2O(l)△H =+3120 kJ·mol-1 |
D.C2H6(g) +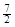 O2(g)=2CO2(g) +3H2O(l)△H =-52.0kJ·mol-1 O2(g)=2CO2(g) +3H2O(l)△H =-52.0kJ·mol-1 |
下列物质的熔、沸点高低顺序中排列正确的是 ( )
| A.金刚石>晶体硅>碳化硅 | B.CI4>CBr4>CCl4>CH4 |
| C.MgO>O2>N2>H2O | D.金刚石>生铁>纯铁>钠 |
 )
)