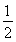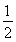摘要:工业生产硫酸过程中.SO2在接触室中被催化氧化为SO3.已知该反应为放热反应.现将2 mol SO2 .1 mol O2充入一密闭容器充分反应后.放出热量98.3 kJ.此时测得SO2的转化率为50%.下列热化学方程式正确的是 A.2SO3(g)2SO2(g)+O2(g),△H=+196.6 kJ/mol B.2SO2(g) +O2(g)2SO3(g) ,△H=-98.3 kJ/mol C.SO2(g)+ 1/2O2(g)SO3(g),△H=+98.3 kJ/mol D.SO2(g)+ 1/2O2(g) SO3(g),△H=-196.6 kJ/mol
网址:http://m.1010jiajiao.com/timu3_id_299495[举报]
工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为一放热反应。现将2 mol SO2、1 mol O2充入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%,则下列热化学方程式正确的是
A.2SO2(g)+O2(g)![]() 2SO3(g);ΔH=-98.3 kJ·mol-1
2SO3(g);ΔH=-98.3 kJ·mol-1
B.SO2(g)+![]() O2(g)
O2(g)![]() SO3(g);ΔH=+98.3 kJ·mol-1
SO3(g);ΔH=+98.3 kJ·mol-1
C.SO2(g)+ ![]() O2(g)
O2(g)![]() SO3(g);ΔH=-196.6 kJ·mol-1
SO3(g);ΔH=-196.6 kJ·mol-1
D.2SO2(g)+O2(g)![]() 2SO3(g);ΔH=-196.6 kJ·mol-1
2SO3(g);ΔH=-196.6 kJ·mol-1
工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为一放热反应。现将2 mol SO2、1 mol O2充入一密闭容器中充分反应后,放出热量98.3 kJ,此时测得SO2的物质的量为1 mol。则下列热化学方程式正确的是( )
| A.2SO2(g)+O2(g)?==?2SO3(g) ΔH=-196.6 kJ·mol-1 |
| B.2SO2(g)+O2(g)?==?2SO3(g) ΔH=-98.3 kJ·mol-1 |
C.SO2(g)+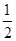 O2(g)?==?SO3(g) ΔH=+98.3 kJ·mol-1 O2(g)?==?SO3(g) ΔH=+98.3 kJ·mol-1 |
D.SO2(g)+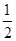 O2(g) ="=" SO3(g) ΔH=+196.6 kJ·mol-1 O2(g) ="=" SO3(g) ΔH=+196.6 kJ·mol-1 |
工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为一放热反应。现将2 mol SO2、1 mol O2充入一密闭容器中充分反应后,放出热量98.3 kJ,此时测得SO2的物质的量为1 mol。则下列热化学方程式正确的是( )
A.2SO2(g)+O2(g)?==?2SO3(g) ΔH=-196.6 kJ·mol-1
B.2SO2(g)+O2(g)?==?2SO3(g) ΔH=-98.3 kJ·mol-1
C.SO2(g)+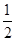 O2(g)?==?SO3(g) ΔH=+98.3 kJ·mol-1
O2(g)?==?SO3(g) ΔH=+98.3 kJ·mol-1
D.SO2(g)+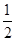 O2(g)
="=" SO3(g) ΔH=+196.6 kJ·mol-1
O2(g)
="=" SO3(g) ΔH=+196.6 kJ·mol-1
查看习题详情和答案>>