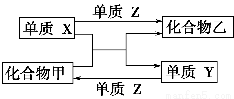
题目内容
工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为放热反应。现将2 mol SO2、1 mol O2充入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%。下列热化学方程式正确的是 ( )。
A.2SO3(g)  2SO2(g)+O2(g)ΔH=+196.6 kJ·mol-1
2SO2(g)+O2(g)ΔH=+196.6 kJ·mol-1
B.2SO2(g)+O2(g)  SO3(g)ΔH=-98.3 kJ·mol-1
SO3(g)ΔH=-98.3 kJ·mol-1
C.SO2(g)+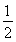 O2(g)
O2(g)  SO3(g)ΔH=+98.3 kJ·mol-1
SO3(g)ΔH=+98.3 kJ·mol-1
D.SO2(g)+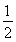 O2(g)
O2(g)  SO3(g)ΔH=-196.6 kJ·mol-1
SO3(g)ΔH=-196.6 kJ·mol-1
A
【解析】从原料的量、SO2的转化率为50%可知,1 mol SO2完全反应放出热量98.3 kJ,故热化学方程式为SO2(g)+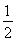 O2(g)
O2(g)  SO3(g) ΔH=-98.3 kJ·mol-1,从而判断出选项B、C、D都错;SO2氧化为SO3的反应放热,故SO3分解过程为吸热,可得2SO3(g)
SO3(g) ΔH=-98.3 kJ·mol-1,从而判断出选项B、C、D都错;SO2氧化为SO3的反应放热,故SO3分解过程为吸热,可得2SO3(g)  2SO2(g)+O2(g) ΔH=+196.6 kJ·mol-1。
2SO2(g)+O2(g) ΔH=+196.6 kJ·mol-1。

 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)=CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2
①上述反应符合“原子经济”原则的是________(填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
温度 | 250 ℃ | 300 ℃ | 350 ℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断,ΔH1______0(填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为________,此时的温度为________(从上表中选择)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)ΔH1=-1 275.6 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g)ΔH2=-566.0 kJ·mol-1
③H2O(g)=H2O(l) ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:__________________________。