题目内容
工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为一放热反应。现将2 mol SO2、1 mol O2充入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%,则下列热化学方程式正确的是A.2SO2(g)+O2(g)![]() 2SO3(g);ΔH=-98.3 kJ·mol-1
2SO3(g);ΔH=-98.3 kJ·mol-1
B.SO2(g)+![]() O2(g)
O2(g)![]() SO3(g);ΔH=+98.3 kJ·mol-1
SO3(g);ΔH=+98.3 kJ·mol-1
C.SO2(g)+ ![]() O2(g)
O2(g)![]() SO3(g);ΔH=-196.6 kJ·mol-1
SO3(g);ΔH=-196.6 kJ·mol-1
D.2SO2(g)+O2(g)![]() 2SO3(g);ΔH=-196.6 kJ·mol-1
2SO3(g);ΔH=-196.6 kJ·mol-1
D
解析:根据SO2的转化率为50%,可以知道1 mol SO2发生反应时,放出的热量为98.3 kJ,则2 mol SO2完全反应放出的热量应该为196.6 kJ,而化学方程式中的化学计量数是代表反应时的变化量,所以A、B、C三项错误,D项正确。

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为一放热反应。现将2 mol SO2、1 mol O2充入一密闭容器中充分反应后,放出热量98.3 kJ,此时测得SO2的物质的量为1 mol。则下列热化学方程式正确的是( )
| A.2SO2(g)+O2(g)?==?2SO3(g) ΔH=-196.6 kJ·mol-1 |
| B.2SO2(g)+O2(g)?==?2SO3(g) ΔH=-98.3 kJ·mol-1 |
C.SO2(g)+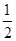 O2(g)?==?SO3(g) ΔH=+98.3 kJ·mol-1 O2(g)?==?SO3(g) ΔH=+98.3 kJ·mol-1 |
D.SO2(g)+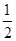 O2(g) ="=" SO3(g) ΔH=+196.6 kJ·mol-1 O2(g) ="=" SO3(g) ΔH=+196.6 kJ·mol-1 |