网址:http://m.1010jiajiao.com/timu3_id_291477[举报]
 是一种可限量使用的铁强化剂
是一种可限量使用的铁强化剂(1)如图为实验室模拟工业制取富马酸亚铁的流程图:

①绿矾(FeSO4?7H20)在保存过程中形成的杂质主要有
②操作Y包括
⑧判断操作Y中“洗涤”富马酸亚铁产品已洗净的实验方法是
(2)设计一个实验方案,证明所得富马酸亚铁产品属于亚铁盐(可供选用的试剂有:KSCN溶液、KMn04溶液、稀硫酸.已知SCN一能被MnO4-氧化).填写下表相应空格:
| 步骤 | 实验操作与现象 |
| ① | 取富马酸亚铁产品l.5g,加入稀硫酸25mL,用水稀释至50ml,加热使其完全溶解并反应,冷却后过滤(除去生成的富马酸及可能过量的反应物),保存滤液. |
| ② | 取少量滤液,滴加KSCN溶液,不显红色 取少量滤液,滴加KSCN溶液,不显红色 |
| ③ | 取酸性高锰酸钾溶液适量,向其中滴加滤液至溶液褪色 取酸性高锰酸钾溶液适量,向其中滴加滤液至溶液褪色 |
| ④ | 取上述褪色后的溶液,滴加KSCN溶液显红色 取上述褪色后的溶液,滴加KSCN溶液显红色 |
铁是人体不可缺少的微量元素,硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下: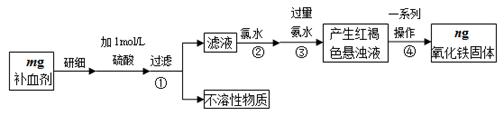
(1)实验中用已经准确量取的浓硫酸配制500 mL 1 mol·L-1的硫酸溶液,则配制时用到的仪器除烧杯、500mL容量瓶外,还需要 。
(2)步骤②加入过量氯水后发生反应的离子方程式为 。
(3)步骤④中一系列操作步骤为 、洗涤、灼烧、冷却、称量。
(4)若实验无损耗,则该补血剂含铁元素的质量分数为 。
(5)某同学发现部分补血剂药片表面发黄,取样品研细,溶于1 mol·L-1的硫酸溶液,过滤。取滤液加 _______________溶液,溶液变红说明该补血剂已部分变质。向变色后的溶液中加入橙汁,溶液红色褪去,说明橙汁含具有 性(填“氧化”或“还原”)的物质。
(6)下列检验(5)中滤液中是否有Fe2+应选用的试剂是 。
| A.KSCN溶液 | B.酸性KMnO4溶液 | C.铁粉 | D.FeCl3溶液 |
铁是人体不可缺少的微量元素,硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:
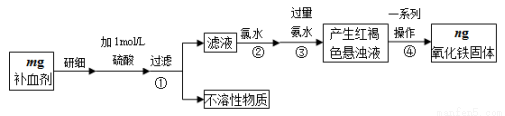
(1)实验中用已经准确量取的浓硫酸配制500 mL 1 mol·L-1的硫酸溶液,则配制时用到的仪器除烧杯、500mL容量瓶外,还需要 。
(2)步骤②加入过量氯水后发生反应的离子方程式为 。
(3)步骤④中一系列操作步骤为 、洗涤、灼烧、冷却、称量。
(4)若实验无损耗,则该补血剂含铁元素的质量分数为 。
(5)某同学发现部分补血剂药片表面发黄,取样品研细,溶于1 mol·L-1的硫酸溶液,过滤。取滤液加 _______________溶液,溶液变红说明该补血剂已部分变质。向变色后的溶液中加入橙汁,溶液红色褪去,说明橙汁含具有 性(填“氧化”或“还原”)的物质。
(6)下列检验(5)中滤液中是否有Fe2+应选用的试剂是 。
A.KSCN溶液 B.酸性KMnO4溶液 C.铁粉 D.FeCl3溶液
查看习题详情和答案>>
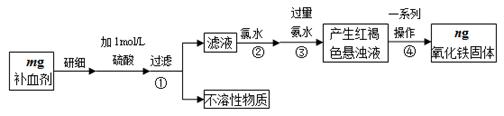
(1)实验中用已经准确量取的浓硫酸配制500 mL 1 mol·L-1的硫酸溶液,则配制时用到的仪器除烧杯、500mL容量瓶外,还需要 。
(2)步骤②加入过量氯水后发生反应的离子方程式为 。
(3)步骤④中一系列操作步骤为 、洗涤、灼烧、冷却、称量。
(4)若实验无损耗,则该补血剂含铁元素的质量分数为 。
(5)某同学发现部分补血剂药片表面发黄,取样品研细,溶于1 mol·L-1的硫酸溶液,过滤。取滤液加 _______________溶液,溶液变红说明该补血剂已部分变质。向变色后的溶液中加入橙汁,溶液红色褪去,说明橙汁含具有 性(填“氧化”或“还原”)的物质。
(6)下列检验(5)中滤液中是否有Fe2+应选用的试剂是 。
| A.KSCN溶液 | B.酸性KMnO4溶液 | C.铁粉 | D.FeCl3溶液 |
下列离子方程式表达不正确的是
| A.在硫酸亚铁溶液中通入氧气:4Fe2++O2+4H+=4Fe3++2H2O |
| B.用0.3mol/L的氯化铵溶液除去氢氧化铝中少量的氢氧化镁: Mg(OH)2 +2NH4+=Mg2++2NH3·H2O |
C.用惰性电极电解硫酸铜溶液:2Cu2++ 2H2O 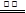 2Cu↓ +O2↑ +4H+ 2Cu↓ +O2↑ +4H+ |
| D.酸性高锰酸钾和过氧化氢制取少量氧气: |