网址:http://m.1010jiajiao.com/timu3_id_291267[举报]
工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4(g)+H2O(g) CO(g)+3H2(g);△H=+206 kJ/mol,一定条件下向体积为1 L的密闭容器中充入1 mol CH4和1 mol H2O,测得CH4(g)和CO(g)的浓度随时间变化曲线如图所示,下列说法正确的是 ( )
CO(g)+3H2(g);△H=+206 kJ/mol,一定条件下向体积为1 L的密闭容器中充入1 mol CH4和1 mol H2O,测得CH4(g)和CO(g)的浓度随时间变化曲线如图所示,下列说法正确的是 ( )
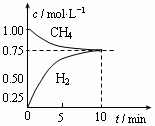
A.10min时用CH4表示的反应速率为0.075 mol•L-1•min-1
B.使用高效催化剂能够增大CO的产率
C.该条件下反应的平衡常数为0.1875
D.升高温度能使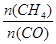 增大
增大
查看习题详情和答案>>
工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4(g)+H2O(g) CO(g)+3H2(g);△H=+206 kJ/mol,一定条件下向体积为1 L的密闭容器中充入1 mol CH4和1 mol H2O,测得CH4(g)和CO(g)的浓度随时间变化曲线如图所示,下列说法正确的是 ( )
CO(g)+3H2(g);△H=+206 kJ/mol,一定条件下向体积为1 L的密闭容器中充入1 mol CH4和1 mol H2O,测得CH4(g)和CO(g)的浓度随时间变化曲线如图所示,下列说法正确的是 ( )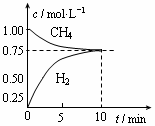
| A.10min时用CH4表示的反应速率为0.075 mol?L-1?min-1 |
| B.使用高效催化剂能够增大CO的产率 |
| C.该条件下反应的平衡常数为0.1875 |
D.升高温度能使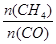 增大 增大 |
一定条件下,体积为1 L的密闭容器中发生如下反应:
SiF4(g)+2H2O(g)(1)下列各项中能说明该反应已达化学平衡状态的是________(填序号).
a.v(SiF4)消耗=4v(HF)生成
b.容器内气体压强不再变化
c.容器内气体的总质量不再变化
d.HF体积分数不再变化
(2)反应过程中测定的部分数据如下表(表中t2>t1):

通过a或b的值及化学平衡原理说明t1时反应是否达到化学平衡状态:________.
(3)若只改变一个条件使上述反应的化学平衡常数变大,该反应________(填序号).
a.一定向正反应方向移动
b.一定向逆反应方向移动
c.一定是减小压强造成的
d.一定是升高温度造成的
e.SiF4的平衡转化率一定增大
(4)反应进行2 min时,容器内气体的密度减小了0.03 g/L,则这2 min内该反应的反应速率v(HF)=________mol(L·min)
SiF4(g)+2H2O(g)?SiO2(s)+4HF(g)△H=+148.9kJ/mol
(1)下列各项中能说明该反应已达化学平衡状态的是
a.υ(SiF4)消耗=υ(HF)生成 b.容器内气体压强不再变化
c.容器内气体的总质量不再变化 d.HF体积分数不再变化
(2)反应过程中测定的部分数据如下表(表中t2>t1):
| 反应时间/min | n(SiF4)/mol | n(H2O)/mol |
| 0 | 1.20 | 2.40 |
| t1 | 0.80 | a |
| t2 | b | 1.60 |
(3)若只改变一个条件使上述反应的化学平衡常数变大,该反应
a.一定向正反应方向移动 b.一定向逆反应方向移动
c.一定是减小压强造成的 d.一定是升高温度造成的
e.SiF4的平衡转化率一定增大
(4)反应进行2min时,容器内气体的密度减小了0.03g/L,则这2min内υ(HF)=