网址:http://m.1010jiajiao.com/timu3_id_288525[举报]
(1)通过控制溶液的pH对工业废水中的金属离子进行分离是实际工作中经常使用的分离方法.下图是某些金属氢氧化物在不同浓度和pH下的沉淀-溶解图.图中直线上的点表示一种平衡状态.通常认为残留在溶液中的离子浓度小于1×10-5mol?L-1时,该离子沉淀完全.
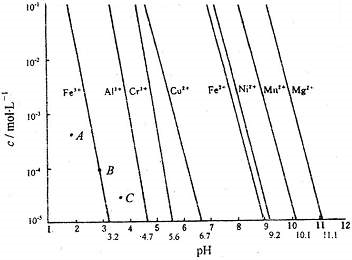
(1)则由上图可得Fe(OH)2的溶度积的值为
(2)上图中A、B、C三点中表示Fe(OH)3的沉淀速率大于溶解速率的是
(3)某工厂废水(pH=2.0,ρ=1.0g?mL-1)中含Ag+、Pb2+等 重金属离子,其浓度各约为0.01mol?L-1.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶电解质 | AgCl | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 1.8×10-10 | 8.3×10-17 | 5.6×10-18 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
A.NaOH B.Na2S C.KI D.Ca(OH)2
②如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=
③如果用食盐处理其只含银离子的废水,测得处理后的废水中NaCl的质量分数为0.117%,若环境要求排放标准为c(Ag+)低于1.0×10-18mol?L-1,则该工厂处理后的废水是否符合排放标准
为测定抗贫血药物复方硫酸亚铁中铁的含量,某化学学习小组进行了以下实验研究。
【实验原理】有些溶液本身无色,但加入其他试剂后会有明显的颜色,溶液颜色的深浅和浓度有关,通过比较颜色的深浅可测定物质的含量。
【实验用品】2.00×10-2 mol/L Fe3+的标准溶液、蒸馏水、5% KSCN溶液、pH=4的HAc-NaAc缓冲溶液、1∶1 HNO3溶液、复方硫酸亚铁药片。
铁架台(铁夹)、100 mL容量瓶、胶头滴管、量筒、烧杯、三脚架、石棉
网、酒精灯、玻璃棒、25 mL比色管、pH试纸。
【实验过程】
(1)配制系列标准溶液:分别量取2.00×10-2 mol/L Fe3+的标准溶液6.00 mL、6.50 mL、
7.00 mL、7.50 mL置于4支25 mL比色管中,再加入1.0 mL 5%KSCN溶液和2.5
mLpH=4的 HAc-NaAc缓冲溶液,加蒸馏水稀释至刻度。
(2)制取待测液:取1片复方硫酸亚铁药片,准确称量其质量,置于50 mL烧杯中,
加入2 mL蒸馏水溶解,再加入2 mL 1∶1 HNO3溶液,小心加热2~3min。冷却
后,全部移入100 mL容量瓶中,再加入4.0 mL 5%KSCN溶液和10.0 mL pH=4
的HAc-NaAc缓冲溶液等,振动、定容、摇匀制得待测液100 mL。取25.00 mL
待测液加入与(1)相同规格的比色管中。
(3)比色:将(2)所得比色管中的溶液与(1)各比色管中的溶液进行比较,确定待测液中Fe3+的浓度范围。
请回答下列问题:
(1)在含有Fe3+的溶液中加入KSCN溶液,溶液显 色。
(2)完成该实验,还缺少的仪器有 、 。
(3)加入pH=4的 HAc-NaAc缓冲溶液的目的是 。
(4)实验中量取 HNO3溶液、HAc-NaAc缓冲溶液量筒即可,原因是 。
(5)标准溶液的浓度过大或过小均对实验结果有影响,则浓度过小对实验结果造成的影响是 。
(6)若测得待测液中Fe3+的物质的量浓度为cmol/L,药片的质量为m,则药片中铁元素的质量分数为 。
查看习题详情和答案>>(1)D元素的名称为


(2)写出液态化合物Y的一种用途
(3)用某种金属易拉罐与A、C、E组成的化合物的水溶液反应,产生的气体可充填气球,请写出该反应的离子方程式
(4)P和Q两种物质都是由A、C、E、F四种元素组成的盐,其水溶液都显酸性,等物质的量的P和Q恰好完全反应.写出该反应的离子方程式:
(5)由A、B两元素形成的化合物W可作为火箭推进器中的强还原剂,已知一个W分子和一个Y分子中都含有18个电子,0.5mol液态W和足量液态Y反应,生成一种无色无味无毒的气体B2和液态X,并放出408.8kJ热量.查资料可知:
2Y(1)=2X(1)+C2(g)△H=-196.4kJ?mol-1写出液态W与气态C2反应生成液态X和气态B2的热化学方程式为
(6)G为氯,以K2CrO4为指示剂,用标准硝酸银溶液可以测定溶液中Cl-的浓度,已知Ksp(AgCl)=1.56ⅹ10-10,Ksp(Ag2CrO4)=1.10ⅹ10-12,Ag2CrO4为砖红色,则滴定终点的现象是
2NO(g)+2CO(g)
| 催化剂 |
为了测定在某种催化剂作用下该反应的反应速率,t1℃下,在一等容的密闭容器中,某科研机构用气体传感器测得了不同时间的NO和CO的浓度如表1(CO2和N2的起始浓度为0).
表1
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/×10-4mol?L-1 | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/×10-3mol?L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
(1)在上述条件下该反应能自发进行,则正反应必然是
(2)前3s内的平均反应速率v(N2)=
(3)假设在密闭容器中发生上述反应,达到平衡时改变下列条件,能提高NO转化率的是
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
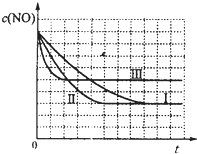
(4)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.根据表2设计的实验测得混合气体中NO的浓度随时间t变化的趋势如图1所示:
| 实验编号 | T/℃ | NO初始浓度/mol?L-1 | CO初始浓度/mol?L-1 | 催化剂的比表面积/m2?g-1 |
| ① | 350 | 1.20×10-2 | 5.80×10-2 | 124 |
| ② | 280 | 1.20×10-2 | 5.80×10-2 | 124 |
| ③ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
(5)已知:N2(g)+O2(g)=2NO(g)△H1=+180.5kJ?mol-1
2C(s)+O2(g)=2CO(g)△H2=-221.0kJ?mol-1
C(s)+O2(g)=CO2(g)△H3=-393.5kJ?mol-1
则处理汽车尾气反应中的a=
(6)用活性炭还原法也可以处理氮氧化物,有关反应为:C(s)+2NO(g)?N2(g)+CO2(g)△H4.向某密闭容器加入一定量的活性炭和NO,在t2℃下反应,
有关数据如表3.
| NO | N2 | CO | |
| 起始浓度mol.L-1 | 0.10 | 0 | 0 |
| 平衡浓度/mol.L-1 | 0.04 | 0.03 | 0.03 |
2NO+2CO
| 催化剂 |
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol?L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol?L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(1)前2s内的平均反应速率v(N2)=
(2)在该温度下,反应的平衡常数K=
(3)在温度和体积保持不变的条件下,能够说明该反应达到平衡状态的标志是
A.反应混合物各组分物质的量浓度相等
B.NO、CO、CO2、N2分子数之比为2:2:2:1
C.混合气体的密度保持不变
D.单位时间内消耗1mol NO的同时,就有1mol CO生成
(4)达到平衡后下列能提高NO转化率的是
A.选用更有效的催化剂 B.保持容器体积不变充入氦气增大压强
C.降低反应体系的温度 D.缩小容器的体积
(5)反应2NO+O2═2NO2 △S<0能自发进行的原因是
(6)①液态肼(N2H4)和液态双氧水混合反应时,即产生大量氮气和水蒸汽,并放出大量的热.已知0.4mol 液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.6kJ的热量.该反应的热化学方程式是
②某燃料电池以肼作为燃料,写出酸性介质中肼参与反应的电极反应式: