摘要:14.如图10-1所示.装置中a为弹簧夹.b为分液漏斗的活塞(通过开.关活塞可以随时滴加液体)先关闭b.打开a.将混有少量CO和CO2气体由左侧导管通入.充分反应后.排出的气体主要是 ,然后关闭a.打开b.一段时间后排出的气体主要是 . 图10-1 答案:CO CO2
网址:http://m.1010jiajiao.com/timu3_id_28061[举报]
如图1所示为实验室常用的实验装置.
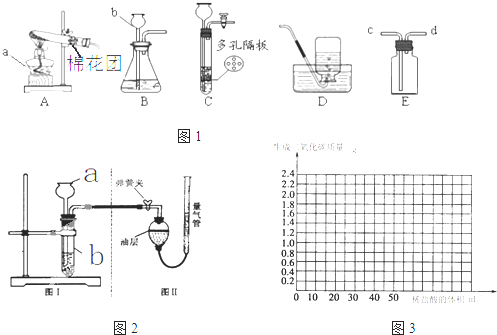
(1)写出下列仪器名称:a
(2)实验室用高锰酸钾制取氧气时,应选择的发生装置是
(3)实验室用锌和稀硫酸反应制取氢气的化学方程式是
(4)装置C相对于装置B在操作方面的优势为
A.可以随时加液 B.可以控制反应速率 C.可以控制反应发生与停止
同学们对美术组的环保石头纸(主要成分为碳酸钙,加入适量聚乙烯和少量胶合剂)展开探究:
[拓展实验一]探究影响石头纸与盐酸反应快慢的因素
(5)甲、乙两同学设计实验如下:
[拓展实验二]测定石头纸中碳酸钙的质量分数
(6)甲组同学的方法是:(同温同压下,不同气体混合后体积等于混合前各气体体积之和.)
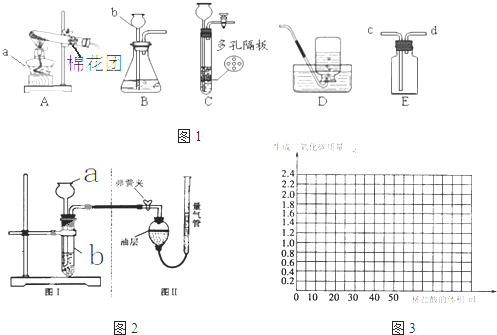
将样品与稀盐酸反应,测定反应后生成CO2的体积,再换算为质量,最后根据CO2的质量求出样品中碳酸钙的质量.图2(Ⅰ)为石头纸与稀盐酸反应的装置,图2(Ⅱ)用于测量CO2的体积.
①连接仪器,夹紧弹簧夹,向a中加入一定量的水,如果a、b中有稳定的高度差,说明:装置2(I)气密性
②图2(Ⅱ)装置中油层的作用是
③反应停止后,
A.水平移动量气管 B.上下移动量气管 C.封闭量气管
(7)乙组同学的实验方法是:均匀称取四份样品分别和稀盐酸反应,用电子天平及有关装置,得出二氧化碳质量,实验数据记录如表.(其他物质既不溶于水也不跟酸反应)
通过对数据的分析和比较,回答下列有关问题:
①在第1份样品的实验中,
②m为
③石头纸样品中碳酸钙的质量分数是多少?(请写出计算过程)
④请在坐标图3中画出在6.25g样品中加入稀盐酸的体积与产生气体质量的关系图.
 .
.
查看习题详情和答案>>

(1)写出下列仪器名称:a
酒精灯
酒精灯
;b长颈漏斗
长颈漏斗
.(2)实验室用高锰酸钾制取氧气时,应选择的发生装置是
A
A
(填装置的字母代号),化学方程式是2KMnO4
K2MnO4+MnO2+O2↑
| ||
2KMnO4
K2MnO4+MnO2+O2↑
,用双氧水制取氧气的化学方程式为
| ||
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.
| ||
(3)实验室用锌和稀硫酸反应制取氢气的化学方程式是
Zn+H2SO4═ZnSO4+H2↑
Zn+H2SO4═ZnSO4+H2↑
,若将E装置中收集的氢气排出,应从c
c
(填c或d)口通入蒸馏水.(4)装置C相对于装置B在操作方面的优势为
C
C
.A.可以随时加液 B.可以控制反应速率 C.可以控制反应发生与停止
同学们对美术组的环保石头纸(主要成分为碳酸钙,加入适量聚乙烯和少量胶合剂)展开探究:
[拓展实验一]探究影响石头纸与盐酸反应快慢的因素
(5)甲、乙两同学设计实验如下:
| 甲 | 乙 | |
| 实验过程 | 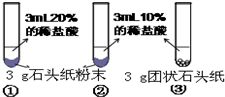 |
 |
| 现象 | 试管①、②、③中产生气泡快慢的顺序为: ①>②>③. |
|
| 分析结论 | Ⅰ碳酸钙与稀盐酸反应的化学方程式为 CaCO3+2HCl═2CaCl2+H2O+CO2↑ CaCO3+2HCl═2CaCl2+H2O+CO2↑ Ⅱ对比甲同学实验①②可知, 盐酸越浓(溶质的质量分数越大) 盐酸越浓(溶质的质量分数越大) ,化学反应的速度越快;Ⅲ对比甲同学实验 ②③ ②③ (填实验序号)可知,反应物的接触面积越大,反应速率越快 快 .Ⅳ乙同学的实验中,数据记录纸上应该连续记录的实验数据是 时间 时间 和锥形瓶及药品的质量或二氧化碳的质量 锥形瓶及药品的质量或二氧化碳的质量 . | |
(6)甲组同学的方法是:(同温同压下,不同气体混合后体积等于混合前各气体体积之和.)
将样品与稀盐酸反应,测定反应后生成CO2的体积,再换算为质量,最后根据CO2的质量求出样品中碳酸钙的质量.图2(Ⅰ)为石头纸与稀盐酸反应的装置,图2(Ⅱ)用于测量CO2的体积.
①连接仪器,夹紧弹簧夹,向a中加入一定量的水,如果a、b中有稳定的高度差,说明:装置2(I)气密性
良好
良好
(选填“良好”或“漏气”)②图2(Ⅱ)装置中油层的作用是
防止二氧化碳溶于水、与水反应或隔绝二氧化碳与水
防止二氧化碳溶于水、与水反应或隔绝二氧化碳与水
;③反应停止后,
B
B
(填序号)可使反应前后油层上方气体压强和外界大气压相同,此时排出水的体积即为生成二氧化碳的体积.A.水平移动量气管 B.上下移动量气管 C.封闭量气管
(7)乙组同学的实验方法是:均匀称取四份样品分别和稀盐酸反应,用电子天平及有关装置,得出二氧化碳质量,实验数据记录如表.(其他物质既不溶于水也不跟酸反应)
| 第一份 | 第二份 | 第三份 | 第四份 | |
| 取样品质量(g) | 6.25 | 6.25 | 6.25 | 6.25 |
| 取稀盐酸的体积(mL) | 10.0 | 20.0 | 30.0 | 40.0 |
| 产生气体的质量(g) | 0.88 | 1.76 | 2.20 | m |
①在第1份样品的实验中,
盐酸
盐酸
完全反应了.②m为
2.20
2.20
③石头纸样品中碳酸钙的质量分数是多少?(请写出计算过程)
④请在坐标图3中画出在6.25g样品中加入稀盐酸的体积与产生气体质量的关系图.


如图1所示为实验室常用的实验装置.

(1)写出下列仪器名称:a______;b______.
(2)实验室用高锰酸钾制取氧气时,应选择的发生装置是______(填装置的字母代号),化学方程式是______,用双氧水制取氧气的化学方程式为______.
(3)实验室用锌和稀硫酸反应制取氢气的化学方程式是______,若将E装置中收集的氢气排出,应从______(填c或d)口通入蒸馏水.
(4)装置C相对于装置B在操作方面的优势为______.
A.可以随时加液 B.可以控制反应速率 C.可以控制反应发生与停止
同学们对美术组的环保石头纸(主要成分为碳酸钙,加入适量聚乙烯和少量胶合剂)展开探究:
[拓展实验一]探究影响石头纸与盐酸反应快慢的因素
(5)甲、乙两同学设计实验如下:
| 甲 | 乙 | |
| 实验过程 |  |  |
| 现象 | 试管①、②、③中产生气泡快慢的顺序为: ①>②>③. | |
| 分析结论 | Ⅰ碳酸钙与稀盐酸反应的化学方程式为______ Ⅱ对比甲同学实验①②可知,______,化学反应的速度越快; Ⅲ对比甲同学实验______(填实验序号)可知,反应物的接触面积越大,反应速率越______. Ⅳ乙同学的实验中,数据记录纸上应该连续记录的实验数据是______ 和______. | |
(6)甲组同学的方法是:(同温同压下,不同气体混合后体积等于混合前各气体体积之和.)
将样品与稀盐酸反应,测定反应后生成CO2的体积,再换算为质量,最后根据CO2的质量求出样品中碳酸钙的质量.图2(Ⅰ)为石头纸与稀盐酸反应的装置,图2(Ⅱ)用于测量CO2的体积.
①连接仪器,夹紧弹簧夹,向a中加入一定量的水,如果a、b中有稳定的高度差,说明:装置2(I)气密性______(选填“良好”或“漏气”)
②图2(Ⅱ)装置中油层的作用是______;
③反应停止后,______(填序号)可使反应前后油层上方气体压强和外界大气压相同,此时排出水的体积即为生成二氧化碳的体积.
A.水平移动量气管 B.上下移动量气管 C.封闭量气管
(7)乙组同学的实验方法是:均匀称取四份样品分别和稀盐酸反应,用电子天平及有关装置,得出二氧化碳质量,实验数据记录如表.(其他物质既不溶于水也不跟酸反应)
| 第一份 | 第二份 | 第三份 | 第四份 | |
| 取样品质量(g) | 6.25 | 6.25 | 6.25 | 6.25 |
| 取稀盐酸的体积(mL) | 10.0 | 20.0 | 30.0 | 40.0 |
| 产生气体的质量(g) | 0.88 | 1.76 | 2.20 | m |
①在第1份样品的实验中,______完全反应了.
②m为______
③石头纸样品中碳酸钙的质量分数是多少?(请写出计算过程)
④请在坐标图3中画出在6.25g样品中加入稀盐酸的体积与产生气体质量的关系图.______. 查看习题详情和答案>>
如图1所示为实验室常用的实验装置.
(1)写出下列仪器名称:a______;b______.
(2)实验室用高锰酸钾制取氧气时,应选择的发生装置是______(填装置的字母代号),化学方程式是______,用双氧水制取氧气的化学方程式为______.
(3)实验室用锌和稀硫酸反应制取氢气的化学方程式是______,若将E装置中收集的氢气排出,应从______(填c或d)口通入蒸馏水.
(4)装置C相对于装置B在操作方面的优势为______.
A.可以随时加液 B.可以控制反应速率 C.可以控制反应发生与停止
同学们对美术组的环保石头纸(主要成分为碳酸钙,加入适量聚乙烯和少量胶合剂)展开探究:
[拓展实验一]探究影响石头纸与盐酸反应快慢的因素
(5)甲、乙两同学设计实验如下:
[拓展实验二]测定石头纸中碳酸钙的质量分数
(6)甲组同学的方法是:(同温同压下,不同气体混合后体积等于混合前各气体体积之和.)
将样品与稀盐酸反应,测定反应后生成CO2的体积,再换算为质量,最后根据CO2的质量求出样品中碳酸钙的质量.图2(Ⅰ)为石头纸与稀盐酸反应的装置,图2(Ⅱ)用于测量CO2的体积.
①连接仪器,夹紧弹簧夹,向a中加入一定量的水,如果a、b中有稳定的高度差,说明:装置2(I)气密性______(选填“良好”或“漏气”)
②图2(Ⅱ)装置中油层的作用是______;
③反应停止后,______(填序号)可使反应前后油层上方气体压强和外界大气压相同,此时排出水的体积即为生成二氧化碳的体积.
A.水平移动量气管 B.上下移动量气管 C.封闭量气管
(7)乙组同学的实验方法是:均匀称取四份样品分别和稀盐酸反应,用电子天平及有关装置,得出二氧化碳质量,实验数据记录如表.(其他物质既不溶于水也不跟酸反应)
通过对数据的分析和比较,回答下列有关问题:
①在第1份样品的实验中,______完全反应了.
②m为______
③石头纸样品中碳酸钙的质量分数是多少?(请写出计算过程)
④请在坐标图3中画出在6.25g样品中加入稀盐酸的体积与产生气体质量的关系图.______.
查看习题详情和答案>>

(1)写出下列仪器名称:a______;b______.
(2)实验室用高锰酸钾制取氧气时,应选择的发生装置是______(填装置的字母代号),化学方程式是______,用双氧水制取氧气的化学方程式为______.
(3)实验室用锌和稀硫酸反应制取氢气的化学方程式是______,若将E装置中收集的氢气排出,应从______(填c或d)口通入蒸馏水.
(4)装置C相对于装置B在操作方面的优势为______.
A.可以随时加液 B.可以控制反应速率 C.可以控制反应发生与停止
同学们对美术组的环保石头纸(主要成分为碳酸钙,加入适量聚乙烯和少量胶合剂)展开探究:
[拓展实验一]探究影响石头纸与盐酸反应快慢的因素
(5)甲、乙两同学设计实验如下:
| 甲 | 乙 | |
| 实验过程 | 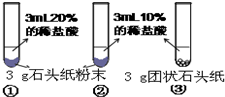 |
 |
| 现象 | 试管①、②、③中产生气泡快慢的顺序为: ①>②>③. |
|
| 分析结论 | Ⅰ碳酸钙与稀盐酸反应的化学方程式为______ Ⅱ对比甲同学实验①②可知,______,化学反应的速度越快; Ⅲ对比甲同学实验______(填实验序号)可知,反应物的接触面积越大,反应速率越______. Ⅳ乙同学的实验中,数据记录纸上应该连续记录的实验数据是______ 和______. | |
(6)甲组同学的方法是:(同温同压下,不同气体混合后体积等于混合前各气体体积之和.)
将样品与稀盐酸反应,测定反应后生成CO2的体积,再换算为质量,最后根据CO2的质量求出样品中碳酸钙的质量.图2(Ⅰ)为石头纸与稀盐酸反应的装置,图2(Ⅱ)用于测量CO2的体积.
①连接仪器,夹紧弹簧夹,向a中加入一定量的水,如果a、b中有稳定的高度差,说明:装置2(I)气密性______(选填“良好”或“漏气”)
②图2(Ⅱ)装置中油层的作用是______;
③反应停止后,______(填序号)可使反应前后油层上方气体压强和外界大气压相同,此时排出水的体积即为生成二氧化碳的体积.
A.水平移动量气管 B.上下移动量气管 C.封闭量气管
(7)乙组同学的实验方法是:均匀称取四份样品分别和稀盐酸反应,用电子天平及有关装置,得出二氧化碳质量,实验数据记录如表.(其他物质既不溶于水也不跟酸反应)
| 第一份 | 第二份 | 第三份 | 第四份 | |
| 取样品质量(g) | 6.25 | 6.25 | 6.25 | 6.25 |
| 取稀盐酸的体积(mL) | 10.0 | 20.0 | 30.0 | 40.0 |
| 产生气体的质量(g) | 0.88 | 1.76 | 2.20 | m |
①在第1份样品的实验中,______完全反应了.
②m为______
③石头纸样品中碳酸钙的质量分数是多少?(请写出计算过程)
④请在坐标图3中画出在6.25g样品中加入稀盐酸的体积与产生气体质量的关系图.______.
“冬天捞碱,夏天晒盐”.这里的“碱”是指Na2CO3,“盐”是指NaCl.
(一)Na2CO3和NaCl的溶解度曲线如图1所示,根据图回答:
①t1℃时Na2CO3的溶解度为
t2℃时Na2CO3的溶解度
②“冬天捞碱”的原因是由于Na2CO3的溶解度随温度降低而
③“夏天晒盐”是利用
A.风吹日晒,使溶剂蒸发 B.升高温度,使NaCl溶解度增大
(二)我国青海湖地区得到的天然碱并不是碳酸钠的晶体,组成可表示为aNa2CO3?bNaHCO3?cH2O(a、b、c为最简整数比).某化学课外活动小组对天然碱的成分进行探究:
小红同学为测定其组成,称取该天然碱样品16.6g进行如图2实验: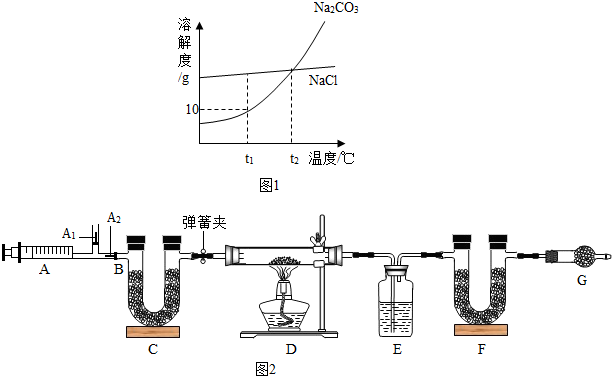
【查阅资料】
(1)碳酸钠比较稳定,加热时不分解;
(2)2NaHCO3
Na2CO3+CO2↑+H2O (3)图中B处为两个单向阀:推注射器时A1关闭,A2处打开;拉注射器时,A1打开进空气,A2关闭.
【实验步骤】
①组装好装置,检查气密性 ②反复推拉注射器 ③称量E、F的质量④关闭弹簧夹,加热D处试管直到反应不再进行 ⑤打开弹簧夹,再次反复缓缓推拉注射器 ⑥再次称量E、F的质量.
【问题探究】
(1)E中的药品为
(2)C、F、G中装有碱石灰(CaO与NaOH的固体混合物),则C的作用是
(3)实验步骤②与③能否颠倒
(4)据下表,16.6g天然碱中结晶水的质量为
查看习题详情和答案>>
(一)Na2CO3和NaCl的溶解度曲线如图1所示,根据图回答:
①t1℃时Na2CO3的溶解度为
10
10
g;t2℃时Na2CO3的溶解度
═
═
NaCl的溶解度.(填“<”、“>”或“=”)②“冬天捞碱”的原因是由于Na2CO3的溶解度随温度降低而
减小
减小
(填“增大”“减小”或“不变”).③“夏天晒盐”是利用
A
A
(填序号)的方法,使NaCl晶体析出.A.风吹日晒,使溶剂蒸发 B.升高温度,使NaCl溶解度增大
(二)我国青海湖地区得到的天然碱并不是碳酸钠的晶体,组成可表示为aNa2CO3?bNaHCO3?cH2O(a、b、c为最简整数比).某化学课外活动小组对天然碱的成分进行探究:
小红同学为测定其组成,称取该天然碱样品16.6g进行如图2实验:

【查阅资料】
(1)碳酸钠比较稳定,加热时不分解;
(2)2NaHCO3
| ||
【实验步骤】
①组装好装置,检查气密性 ②反复推拉注射器 ③称量E、F的质量④关闭弹簧夹,加热D处试管直到反应不再进行 ⑤打开弹簧夹,再次反复缓缓推拉注射器 ⑥再次称量E、F的质量.
【问题探究】
(1)E中的药品为
浓硫酸
浓硫酸
,E的作用是吸收水蒸气
吸收水蒸气
.(2)C、F、G中装有碱石灰(CaO与NaOH的固体混合物),则C的作用是
除去空气中的二氧化碳、水蒸气等杂质气体
除去空气中的二氧化碳、水蒸气等杂质气体
,F的作用是吸收生成的二氧化碳
吸收生成的二氧化碳
,G的作用是防止空气中的二氧化碳和水蒸气等杂质气体进入到F中,影响二氧化碳质量的测定
防止空气中的二氧化碳和水蒸气等杂质气体进入到F中,影响二氧化碳质量的测定
.(3)实验步骤②与③能否颠倒
不能
不能
(填“能”或“不能”).若不进行步骤⑤的操作,则所测得的碳酸氢钠质量分数偏小
偏小
(填“偏大”、“偏小”、“无影响”),该操作中推注射器时缓缓的目的是使生成的二氧化碳、水蒸气吸收充分
使生成的二氧化碳、水蒸气吸收充分
(4)据下表,16.6g天然碱中结晶水的质量为
1.8
1.8
g,Na2CO3的质量为10.6
10.6
g,该天然碱的化学式中a:b:c=2:1:2
2:1:2
.| 反应前 | 反应后 |
| E的质量为100.0g | E的质量为102.25g |
| F的质量为50.0g | F的质量为51.1g |
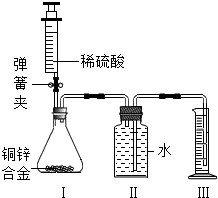
某化学小组利用如图所示装置(图中固定装置已略去)测定铜锌合金中锌的质量分数.探究过程如下:
①连接实验装置并检查装置气密性.
②向装置Ⅰ中的锥形瓶加入2.0g的铜锌合金样品粉末,由注射器缓缓注入稀硫酸,待到锥形瓶中不再产生气体时,准确读取注射器内读数,减少10.5mL稀硫酸,同时立即夹紧弹簧夹,移出装置Ⅲ中的导管,准确读取量筒内水的体积为214.0mL.(注:样品中的杂质不参加反应
③装置Ⅰ中剩余固体物质经过适当处理后,准确称量其质量1.4g.
④该小组的三位同学利用实验过程测得不同数据,计算铜锌合金样品中锌的质量分数.
甲同学利用装置Ⅰ中反应前后固体的质量进行计算;
乙同学利用装置Ⅰ中加入稀硫酸的量进行计算;
丙同学利用装置Ⅲ中量取水的体积进行计算,并查得:在标准状况下,氢气的密度为0.09g/L.
回答下列问题:
(1)装置Ⅰ中反应的化学方程式为______,实验过程中须加入稀硫酸至不再产生气体,目的是______.
(2)步骤③中称量剩余固体之前的正确操作是______、洗涤、干燥.
(3)根据实验测定的数据,上述三位同学中______(填“甲”、“乙”或“丙”)同学无法进行计算样品中锌的质量分数.
(4)化学小组同学发现:按照丙同学的方案进行计算,致使实验结果出现较大偏差.以下因素可能造成偏差的有______(填标号).
A.移出装置Ⅲ时,导管内留存了一部分水
B.实验测量前,没有排除装置Ⅰ中的空气
C.数据处理时,未排除加入稀硫酸所占的体积.
查看习题详情和答案>>
①连接实验装置并检查装置气密性.
②向装置Ⅰ中的锥形瓶加入2.0g的铜锌合金样品粉末,由注射器缓缓注入稀硫酸,待到锥形瓶中不再产生气体时,准确读取注射器内读数,减少10.5mL稀硫酸,同时立即夹紧弹簧夹,移出装置Ⅲ中的导管,准确读取量筒内水的体积为214.0mL.(注:样品中的杂质不参加反应
③装置Ⅰ中剩余固体物质经过适当处理后,准确称量其质量1.4g.
④该小组的三位同学利用实验过程测得不同数据,计算铜锌合金样品中锌的质量分数.
甲同学利用装置Ⅰ中反应前后固体的质量进行计算;
乙同学利用装置Ⅰ中加入稀硫酸的量进行计算;
丙同学利用装置Ⅲ中量取水的体积进行计算,并查得:在标准状况下,氢气的密度为0.09g/L.
回答下列问题:
(1)装置Ⅰ中反应的化学方程式为______,实验过程中须加入稀硫酸至不再产生气体,目的是______.
(2)步骤③中称量剩余固体之前的正确操作是______、洗涤、干燥.
(3)根据实验测定的数据,上述三位同学中______(填“甲”、“乙”或“丙”)同学无法进行计算样品中锌的质量分数.
(4)化学小组同学发现:按照丙同学的方案进行计算,致使实验结果出现较大偏差.以下因素可能造成偏差的有______(填标号).
A.移出装置Ⅲ时,导管内留存了一部分水
B.实验测量前,没有排除装置Ⅰ中的空气
C.数据处理时,未排除加入稀硫酸所占的体积.
