摘要:11.已知反应:PCl5(g)PCl3(g)+Cl2(g) ①, 2HI(g)H2(g)+I2(g) ②,2NO2(g)N2O4(g) ③.在一定 条件下.达到化学平衡时.反应物的转化率均是a%.若保持各反应的温度和容器的体积都不改变.分别在加入一定量的各自的反应物.则转化率 ( ) A.均不变 B.均增大 C.①增大.②不变.③减小 D.①减小.②不变.③增大
网址:http://m.1010jiajiao.com/timu3_id_273449[举报]
 红磷 P(s)和 Cl2(g)发生反应生成 PCl3(g)和 PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成 1 mol 产物的数据).
红磷 P(s)和 Cl2(g)发生反应生成 PCl3(g)和 PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成 1 mol 产物的数据).根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是
P(s)+
Cl2(g)═PCl3(g)△H=-306kJ?mol-1
| 3 |
| 2 |
P(s)+
Cl2(g)═PCl3(g)△H=-306kJ?mol-1
.| 3 |
| 2 |
(2)PCl5分解成 PCl3和Cl2的热化学方程式是
PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJ?mol-1
PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJ?mol-1
.(3)P和Cl2分两步反应生成1molPCl5的△H3=
-399kJ?mol-1
-399kJ?mol-1
,P和Cl2一步反应生成1molPCl5的△H4等于
等于
△H3(填“大于”、“小于”或“等于”).(4)PCl5 与足量水充分反应,最终生成两种酸,已知反应前后各元素化合价不变,其化学方程式是
PCl5+4H2O═H3PO4+5HCl
PCl5+4H2O═H3PO4+5HCl
.
已知PCl3、PCl5在潮湿空气中易发生下列反应,PCl3+3H2O====H3PO3+3HCl,PCl5+4H2O====H3PO4+5HCl。某人设计以下实验为清楚观察到P在Cl2中燃烧分步生成PCl3、PCl5的现象。
先把干燥氯气贮存在100 mL的注射器内,再把火柴头大小的红磷置于玻璃燃烧匙上烘干后组成如图装置。
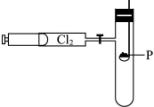
操作分两步进行。首先打开弹簧夹,缓慢推动注射器的针塞,待磷燃烧出现白雾时,立即关闭弹簧夹,停止推入Cl2,片刻后,可见到试管内白雾凝成无色液滴附在试管内壁。然后再打开弹簧夹,继续推入Cl2,就可看到管壁上液滴逐渐消失,管内出现白烟。最后白烟凝结成白色固体附着在试管内壁上。
试完成下列问题:
(1)该实验选择玻璃燃烧匙,不选其他金属燃烧匙的原因是_______________________。
(2)该实验的关键是使用的氯气和红磷必须干燥,其原因是_______________________。
(3)第二次通入氯气时发生反应的化学方程式是_________________________________,推入Cl2之所以要缓慢进行的原因是_________________________________。
查看习题详情和答案>>已知反应PCl5(g)![]() PCl3(g)+Cl2(g)在230℃达到平衡,平衡混合物中各物质的浓度分别是c(PCl5)=0.47 mol/L,c(PCl3)=0.098 mol/L,c(Cl2)=0.098 mol/L,则这个反应在230℃时的平衡常数为________.
PCl3(g)+Cl2(g)在230℃达到平衡,平衡混合物中各物质的浓度分别是c(PCl5)=0.47 mol/L,c(PCl3)=0.098 mol/L,c(Cl2)=0.098 mol/L,则这个反应在230℃时的平衡常数为________.
PCl5的热分解反应如下:PCl5(g)?PCl3(g)+Cl2(g)
(1)写出反应的平衡常数表达式;
(2)已知某温度下,在容积为10.0L的密闭容器中充入2.00mol PCl5,达到平衡后,测得容器内PCl3的浓度为0.150mol/L.计算该温度下的平衡常数.
查看习题详情和答案>>
(1)写出反应的平衡常数表达式;
(2)已知某温度下,在容积为10.0L的密闭容器中充入2.00mol PCl5,达到平衡后,测得容器内PCl3的浓度为0.150mol/L.计算该温度下的平衡常数.
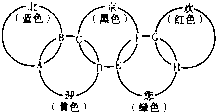 “北、京、欢、迎、您”分别代表五种不同颜色的单质,它们之间相互交叉形成了如图所示的奥运五环旗,A、B、C、D、E、F、G、H是由相交叉的两环元素组成的化合物.
“北、京、欢、迎、您”分别代表五种不同颜色的单质,它们之间相互交叉形成了如图所示的奥运五环旗,A、B、C、D、E、F、G、H是由相交叉的两环元素组成的化合物.已知:蓝色的“北”是液态O2,红色的“欢”是固态非金属单质,1mol G可与1mol“您”恰好反应生成1mol H,F的溶液可与A反应生成酸M、酸N和E的溶液,C高温煅烧可制得A,此反应是工业上制取酸M的基础反应.请回答下列问题:
(1)“京”是
铁
铁
,“欢”的同素异形体是白磷
白磷
.(2)写出F的溶液与A反应生成酸M、酸N和E的溶液的化学方程式:
2FeCl3+SO2+2H2O═H2SO4+2HCl+2FeCl2
2FeCl3+SO2+2H2O═H2SO4+2HCl+2FeCl2
,该反应为氧化还原反应,还原产物为FeCl2
FeCl2
.(3)工业上以C为基础原料,制取酸M产生的工业尾气直接排放到大气中会造成环境污染,处理该尾气中以得到一种化肥,写出该肥料的化学式:
(NH4)2SO4
(NH4)2SO4
.(4)已知:P(s)+
| 3 |
| 2 |
| 5 |
| 2 |
PCl5(g)═Cl2(g)+PCl3(g)△H=+211.0kJ/mol
PCl5(g)═Cl2(g)+PCl3(g)△H=+211.0kJ/mol
.