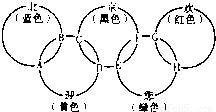
题目内容
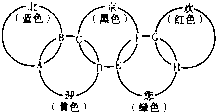 “北、京、欢、迎、您”分别代表五种不同颜色的单质,它们之间相互交叉形成了如图所示的奥运五环旗,A、B、C、D、E、F、G、H是由相交叉的两环元素组成的化合物.
“北、京、欢、迎、您”分别代表五种不同颜色的单质,它们之间相互交叉形成了如图所示的奥运五环旗,A、B、C、D、E、F、G、H是由相交叉的两环元素组成的化合物.已知:蓝色的“北”是液态O2,红色的“欢”是固态非金属单质,1mol G可与1mol“您”恰好反应生成1mol H,F的溶液可与A反应生成酸M、酸N和E的溶液,C高温煅烧可制得A,此反应是工业上制取酸M的基础反应.请回答下列问题:
(1)“京”是
铁
铁
,“欢”的同素异形体是白磷
白磷
.(2)写出F的溶液与A反应生成酸M、酸N和E的溶液的化学方程式:
2FeCl3+SO2+2H2O═H2SO4+2HCl+2FeCl2
2FeCl3+SO2+2H2O═H2SO4+2HCl+2FeCl2
,该反应为氧化还原反应,还原产物为FeCl2
FeCl2
.(3)工业上以C为基础原料,制取酸M产生的工业尾气直接排放到大气中会造成环境污染,处理该尾气中以得到一种化肥,写出该肥料的化学式:
(NH4)2SO4
(NH4)2SO4
.(4)已知:P(s)+
| 3 |
| 2 |
| 5 |
| 2 |
PCl5(g)═Cl2(g)+PCl3(g)△H=+211.0kJ/mol
PCl5(g)═Cl2(g)+PCl3(g)△H=+211.0kJ/mol
.分析:由单质的颜色可知京为Fe,欢为P,迎为S,您为Cl2,C高温煅烧可制得A,A为SO2,B为SO3,P和Cl2反应可生成PCl3或PCl5,1mol G可与1mol“您”恰好反应生成1molH,则G为PCl3,H为PCl5,Fe和Cl元素可组成FeCl2或FeCl3,题中告诉F的溶液与A反应生成酸M、酸N和E的溶液,说明F为FeCl3,E为FeCl2,S和Fe可组成FeS2或FeS,工业常用FeS2为原料生产硫酸,结合题给信息解答该题.
解答:解:由单质的颜色可知京为Fe,欢为P,迎为S,您为Cl2,C高温煅烧可制得A,A为SO2,B为SO3,P和Cl2反应可生成PCl3或PCl5,1mol G可与1mol“您”恰好反应生成1molH,则G为PCl3,H为PCl5,Fe和Cl元素可组成FeCl2或FeCl3,题中告诉F的溶液与A反应生成酸M、酸N和E的溶液,说明F为FeCl3,E为FeCl2,S和Fe可组成FeS2或FeS,工业常用FeS2为原料生产硫酸,
(1)由以上分析可知“京”是铁,“欢”是红磷,对应的同素异形体是白磷,故答案为:铁;白磷;
(2)FeCl3具有氧化性,SO2具有还原性,二者发生氧化还原反应,
反应的方程式为2FeCl3+SO2+2H2O═H2SO4+2HCl+2FeCl2,由化合价的变化可知还原剂为FeCl2,
故答案为:2FeCl3+SO2+2H2O═H2SO4+2HCl+2FeCl2;FeCl2;
(3)S和Fe可组成FeS2或FeS,工业常用FeS2为原料生产硫酸,则C为FeS2,生成的SO2会污染大气,可用氨气处理,最终得到(NH4)2SO4,故答案为:(NH4)2SO4;
(4)已知:①P(s)+
Cl2(g)=PCl3(g)△H=-287.7kJ/mol,
②P(s)+
Cl2(g)=PCl5(g)△H=-498.7kJ/mol,
利用盖斯定律,将①-②可得PCl5(g)═Cl2(g)+PCl3(g)△H=(-287.7kJ/mol)-(-498.7kJ/mol)=+211.0kJ/mol,
故答案为:PCl5(g)═Cl2(g)+PCl3(g)△H=+211.0kJ/mol.
(1)由以上分析可知“京”是铁,“欢”是红磷,对应的同素异形体是白磷,故答案为:铁;白磷;
(2)FeCl3具有氧化性,SO2具有还原性,二者发生氧化还原反应,
反应的方程式为2FeCl3+SO2+2H2O═H2SO4+2HCl+2FeCl2,由化合价的变化可知还原剂为FeCl2,
故答案为:2FeCl3+SO2+2H2O═H2SO4+2HCl+2FeCl2;FeCl2;
(3)S和Fe可组成FeS2或FeS,工业常用FeS2为原料生产硫酸,则C为FeS2,生成的SO2会污染大气,可用氨气处理,最终得到(NH4)2SO4,故答案为:(NH4)2SO4;
(4)已知:①P(s)+
| 3 |
| 2 |
②P(s)+
| 5 |
| 2 |
利用盖斯定律,将①-②可得PCl5(g)═Cl2(g)+PCl3(g)△H=(-287.7kJ/mol)-(-498.7kJ/mol)=+211.0kJ/mol,
故答案为:PCl5(g)═Cl2(g)+PCl3(g)△H=+211.0kJ/mol.
点评:本题考查无机物的推断,题目难度较大,注意把握常见单质的颜色,为解答该题的关键,答题时注意把握题给信息.

练习册系列答案
相关题目
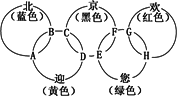
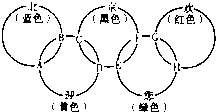 “北、京、欢、迎、您”分别代表五种不同颜色的单质,它们之间相互交叉形成了如图所示的奥运五环旗,A、B、C、D、E、F、G、H是由相交叉的两环元素组成的化合物.
“北、京、欢、迎、您”分别代表五种不同颜色的单质,它们之间相互交叉形成了如图所示的奥运五环旗,A、B、C、D、E、F、G、H是由相交叉的两环元素组成的化合物.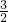 Cl2(g)=PCl3(g);△H=-287.7kJ/mol,P(s)+
Cl2(g)=PCl3(g);△H=-287.7kJ/mol,P(s)+ Cl2(g)=PCl5(g);△H=-498.7kJ/mol.则PCl5(g)分解生成PCl3(g)和Cl2(g)反应的热化学方程式为:______.
Cl2(g)=PCl5(g);△H=-498.7kJ/mol.则PCl5(g)分解生成PCl3(g)和Cl2(g)反应的热化学方程式为:______.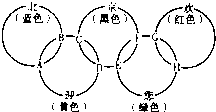
 Cl2(g)=PCl3(g);△H=-287.7kJ/mol,P(s)+
Cl2(g)=PCl3(g);△H=-287.7kJ/mol,P(s)+ Cl2(g)=PCl5(g);△H=-498.7kJ/mol.则PCl5(g)分解生成PCl3(g)和Cl2(g)反应的热化学方程式为:______.
Cl2(g)=PCl5(g);△H=-498.7kJ/mol.则PCl5(g)分解生成PCl3(g)和Cl2(g)反应的热化学方程式为:______.