网址:http://m.1010jiajiao.com/timu3_id_268096[举报]
现代物质结构理论原理证实,原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,处于最低能量的原子叫做________原子.当电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道,而且自旋方向相同,这个规则被称为________.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的 一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未 成对电子;Q原子s能级与P能级电子数相等;R单质是制造各种计算机、微电子产品 的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
(1)Y原子核外共有
(2)X、Y、Z的第一电离能由小到大的顺序为
(3)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化轨道类 型为
(4)Z与R能形成化合物甲,1mol甲中含
(5)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为
| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 | 熔点/K | 993 | 1539 | 183 |
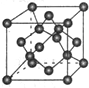
(7)X单质的晶胞如图所示,一个X晶胞中有
硫的化合物在生产和科研中发挥着重要作用。
(1)SO2Cl2常用于制造医药品、染料、表面活性剂等。已知:SO2Cl2(g) SO2(g)+Cl2(g)? △H=+97.3 kJ·mol-1。某温度时向体积为1 L的恒容密闭容器中充入0. 20mol SO2Cl2,达到平衡时,容器中含0.18mol SO2,则此过程反应吸收的热量为_____kJ,该温度时反应的平衡常数为_____。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为_______。
SO2(g)+Cl2(g)? △H=+97.3 kJ·mol-1。某温度时向体积为1 L的恒容密闭容器中充入0. 20mol SO2Cl2,达到平衡时,容器中含0.18mol SO2,则此过程反应吸收的热量为_____kJ,该温度时反应的平衡常数为_____。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为_______。
(2)工业上制备硫酸的过程中存在反应:2SO2(g)+O2(g) 2SO3(g) △H=-198kJ·mol-1400℃,1.01×105Pa,向容积为2L的恒容密闭容器中充入一定量 SO2和O2,n(SO3)和n(O2)随时间的变化曲线如图所示。
2SO3(g) △H=-198kJ·mol-1400℃,1.01×105Pa,向容积为2L的恒容密闭容器中充入一定量 SO2和O2,n(SO3)和n(O2)随时间的变化曲线如图所示。
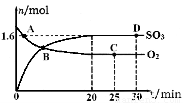
①0~20min反应的平均速率υ(O2)=___________。
②下列叙述正确的是???????? 。
a.A点υ正(SO2)>υ逆(SO2)
b.B点处于平衡状态
c.C点和D点n(SO2)相同
d.其它条件不变,500℃时反应达平衡,n(SO3)比图中D点的值大
(3)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol·L-1的Na2SO3溶液,当溶液pH约为6时,Na2SO3溶液吸收SO2的能力显著下降,应更换吸收剂。此时溶液中c (SO32-)的浓度是0.2 mol·L-1,则溶液中c(HSO3-)是_________mol·L-1。
查看习题详情和答案>>
硫的化合物在生产和科研中发挥着重要作用。
(1)SO2Cl2常用于制造医药品、染料、表面活性剂等。已知:SO2Cl2(g) SO2(g)+Cl2(g) △H=+97.3 kJ·mol-1。某温度时向体积为1 L的恒容密闭容器中充入0. 20mol SO2Cl2,达到平衡时,容器中含0.18mol SO2,则此过程反应吸收的热量为_____kJ,该温度时反应的平衡常数为_____。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为_______。
SO2(g)+Cl2(g) △H=+97.3 kJ·mol-1。某温度时向体积为1 L的恒容密闭容器中充入0. 20mol SO2Cl2,达到平衡时,容器中含0.18mol SO2,则此过程反应吸收的热量为_____kJ,该温度时反应的平衡常数为_____。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为_______。
(2)工业上制备硫酸的过程中存在反应:2SO2(g)+O2(g) 2SO3(g) △H=-198kJ·mol-1400℃,1.01×105Pa,向容积为2L的恒容密闭容器中充入一定量 SO2和O2,n(SO3)和n(O2)随时间的变化曲线如图所示。
2SO3(g) △H=-198kJ·mol-1400℃,1.01×105Pa,向容积为2L的恒容密闭容器中充入一定量 SO2和O2,n(SO3)和n(O2)随时间的变化曲线如图所示。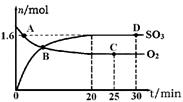
①0~20min反应的平均速率υ(O2)=___________。
②下列叙述正确的是 。
a.A点υ正(SO2)>υ逆(SO2)
b.B点处于平衡状态
c.C点和D点n(SO2)相同
d.其它条件不变,500℃时反应达平衡,n(SO3)比图中D点的值大
(3)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol·L-1的Na2SO3溶液,当溶液pH约为6时,Na2SO3溶液吸收SO2的能力显著下降,应更换吸收剂。此时溶液中c (SO32-)的浓度是0.2 mol·L-1,则溶液中c(HSO3-)是_________mol·L-1。
硫的化合物在生产和科研中发挥着重要作用。
(1)SO2Cl2常用于制造医药品、染料、表面活性剂等。已知:SO2Cl2(g) SO2(g)+Cl2(g) △H=+97.3 kJ·mol-1。某温度时向体积为1 L的恒容密闭容器中充入0. 20mol SO2Cl2,达到平衡时,容器中含0.18mol SO2,则此过程反应吸收的热量为_____ kJ,该温度时反应的平衡常数为_____。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为_______。
SO2(g)+Cl2(g) △H=+97.3 kJ·mol-1。某温度时向体积为1 L的恒容密闭容器中充入0. 20mol SO2Cl2,达到平衡时,容器中含0.18mol SO2,则此过程反应吸收的热量为_____ kJ,该温度时反应的平衡常数为_____。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为_______。
(2)工业上制备硫酸的过程中存在反应:2SO2(g)+O2(g) 2SO3(g) △H=-198kJ·mol-1,400℃,1.01×105Pa,向容积为2L的恒容密闭容器中充入一定量 SO2和O2,n(SO3)和n(O2)随时间的变化曲线如图所示。
2SO3(g) △H=-198kJ·mol-1,400℃,1.01×105Pa,向容积为2L的恒容密闭容器中充入一定量 SO2和O2,n(SO3)和n(O2)随时间的变化曲线如图所示。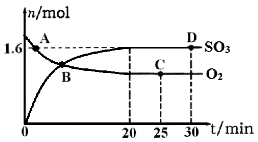
①0~20min反应的平均速率υ(O2)=___________。
②下列叙述正确的是 。
a.A点υ正(SO2)>υ逆(SO2)
b.B点处于平衡状态
c.C点和D点n(SO2)相同
d.其它条件不变,500℃时反应达平衡,n(SO3)比图中D点的值大
(3)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol·L-1的Na2SO3溶液,当溶液pH约为6时,Na2SO3溶液吸收SO2的能力显著下降,应更换吸收剂。此时溶液中c (SO32-)的浓度是0.2 mol·L-1,则溶液中c(HSO3-)是__mol·L-1。