题目内容
硫的化合物在生产和科研中发挥着重要作用。
(1)SO2Cl2常用于制造医药品、染料、表面活性剂等。已知:SO2Cl2(g) SO2(g)+Cl2(g)? △H=+97.3 kJ·mol-1。某温度时向体积为1 L的恒容密闭容器中充入0. 20mol SO2Cl2,达到平衡时,容器中含0.18mol SO2,则此过程反应吸收的热量为_____kJ,该温度时反应的平衡常数为_____。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为_______。
SO2(g)+Cl2(g)? △H=+97.3 kJ·mol-1。某温度时向体积为1 L的恒容密闭容器中充入0. 20mol SO2Cl2,达到平衡时,容器中含0.18mol SO2,则此过程反应吸收的热量为_____kJ,该温度时反应的平衡常数为_____。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为_______。
(2)工业上制备硫酸的过程中存在反应:2SO2(g)+O2(g) 2SO3(g) △H=-198kJ·mol-1400℃,1.01×105Pa,向容积为2L的恒容密闭容器中充入一定量 SO2和O2,n(SO3)和n(O2)随时间的变化曲线如图所示。
2SO3(g) △H=-198kJ·mol-1400℃,1.01×105Pa,向容积为2L的恒容密闭容器中充入一定量 SO2和O2,n(SO3)和n(O2)随时间的变化曲线如图所示。
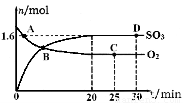
①0~20min反应的平均速率υ(O2)=___________。
②下列叙述正确的是???????? 。
a.A点υ正(SO2)>υ逆(SO2)
b.B点处于平衡状态
c.C点和D点n(SO2)相同
d.其它条件不变,500℃时反应达平衡,n(SO3)比图中D点的值大
(3)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol·L-1的Na2SO3溶液,当溶液pH约为6时,Na2SO3溶液吸收SO2的能力显著下降,应更换吸收剂。此时溶液中c (SO32-)的浓度是0.2 mol·L-1,则溶液中c(HSO3-)是_________mol·L-1。
(17分)(1)17.5(3分) 1.62(3分) 46.6g(3分)
(2)0.02mol(L·min) (3分) ac(2分)? (3)1.6mol/L(3分)
【解析】
试题分析:(1)达到平衡时,容器中含0.18mol SO2,则根据热化学方程式可知,此过程反应吸收的热量为97.3 kJ·mol-1×0.18mol=17.5kJ。根据方程式可知
SO2Cl2(g) SO2(g)+Cl2(g)
SO2(g)+Cl2(g)
起始浓度(mol/L)??? 0.20????????? 0?????? 0
转化浓度(mol/L)?? 0.18???????? 0.18???? 0.18
平衡浓度(mol/L)?? 0.02???????? 0.18???? 0.18
所以该温度下反应的平衡常数K=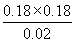 =1.62。
=1.62。
所得混合气体溶于足量BaCl2溶液中,发生反应SO2+Cl2+2H2O=H2SO4+2HCl,所以促使平衡持续向正反应方向进行,因此最终生成沉淀的物质的量是0.20mol,则硫酸钡的质量为0.20mol×232g/mol=46.6g。
(2)①根据图像可知20min时三氧化硫的物质的量是1.6mol,则消耗氧气的物质的量是0.8mol,浓度是0.4mol/L,所以0~20min反应的平均速率υ(O2)=0.4mol/L÷20min=0.02mol(L·min);
②a.根据图像可知A点反应没有达到平衡状态,平衡向正反应方向进行,则υ正(SO2)>υ逆(SO2),a正确;b.B点物质的浓度仍然是变化的,反应没有处于平衡状态,b不正确;c.C点和D点均是相同条件下的平衡状态,因此n(SO2)相同,c正确;d.正方应是放热反应,其它条件不变,升高温度平衡向逆反应方向移动,所以500℃时反应达平衡,n(SO3)比图中D点的值小,d不正确,答案选ac。
(3)溶液中c (SO32-)的浓度是0.2 mol·L-1,则消耗c (SO32-)的浓度=1.0mol/L-0.2mol/L=0.8mol/L,因此根据方程式SO32-+SO2+H2O=2HSO3-可知溶液c(HSO3-)=0.8mol/L×2=1.6mol/L。
考点:考查反应热、反应速率、平衡常数的有关计算;外界条件对平衡状态的影响以及溶液中离子浓度和沉淀生成的有关计算

 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 元素周期表中第四周期的金属元素在生产和科研中有非常重要的使用价值.
元素周期表中第四周期的金属元素在生产和科研中有非常重要的使用价值.
