网址:http://m.1010jiajiao.com/timu3_id_265520[举报]
精制氯化钾在工业上可用于制备各种含钾的化合物.完成下列填空∶
1.工业氯化钾中含有Fe3+、SO42-、Br-等杂质离子,可按如下步骤进行精制,完成各步内容.
①溶解;②加入试剂至Fe3+、SO42-沉淀完全,煮沸;③________;④加入盐酸调节pH;⑤________(除Br-);⑥蒸干灼烧.
步骤②中,依次加入的沉淀剂是NH3·H2O、________、________.
证明Fe3+已沉淀完全的操作是________.
2.有人尝试用工业制纯碱原理来制备K2CO3.他向饱和KCl溶液中依次通入足量的________和________两种气体,充分反应后有白色晶体析出.将得到的白色晶体洗涤后灼烧,结果无任何固体残留,且产生的气体能使澄清石灰水变浑浊.写出生成白色晶体的化学方程式∶________.分析该方法得不到K2CO3的原因可能是________.
3.用氯化钾制备氢氧化钾的常用方法是离子交换膜电解法.氢氧化钾在________极区产生.为了避免两极产物间发生副反应,位于电解槽中间的离子交换膜应阻止________(填“阴”、“阳”或“所有”)离子通过.
4.科学家最近开发了一种用氯化钾制氢氧化钾的方法.其反应可分为5步(若干步已合并,条件均省略).请写出第⑤步反应的化学方程式.
第①、②步(合并)∶2KCl+4HNO3→2KNO3+Cl2+2NO2+2H2O
第③、④步(合并)∶4KNO3+2H2O→4KOH+4NO2+O2
第⑤步∶________
总反应∶4KCl+O2+2H2O→4KOH+2Cl2
与电解法相比,该方法的优势可能是________.
(1)若用铁和稀硫酸制备绿矾(FeSO4?7H2O)过程中,其中
(2)要从溶液中得到绿矾,必须进行的实验操作是
a.过滤洗涤 b.蒸发浓缩 c.冷却结晶 d.灼烧 e.干燥
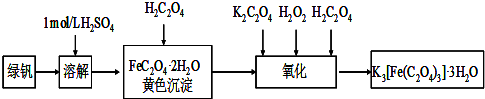
某兴趣小组为测定三草酸合铁酸钾晶体(K3[Fe(C2O4)3]?3H2O)中铁元素含量,做了如下实验:
步骤1:称量5.000g三草酸合铁酸钾晶体,配制成250ml溶液.
步骤2:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部被氧化成二氧化碳,同时,MnO4-被还原成Mn2+.向反应后的溶液中加入一定量锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍里酸性.
步骤3:在酸性条件下,用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,共做三次实验,平均消耗KMnO4溶液20.00ml,滴定中MnO4-,被还原成Mn2+.
(3)步骤1中,配制三草酸合铁酸钾溶液需要使用的玻璃仪器除烧杯、玻璃棒以外还有
(4)步骤2中,加入锌粉的目的是
(5)步骤3中,发生反应的离子方程式为:
(6)步骤2中,若加入的KMnO4的溶液的量不够,则测得的铁含量
(7)某同学将8.74g无水三草酸合铁酸钾(K3[Fe(C2O4)3])在一定条件下加热分解,所得固体的质量为5.42g,同时得到密度为1.647g/L(已折合成标准状况下)气体.研究固体产物得知,铁元素不可能以三价形式存在,而盐只有K2CO3.写出该分解反应的化学方程式
三草酸合铁(Ⅲ)酸钾晶体K3[Fe(C2O4)3]·3H2O可用于摄影和蓝色印刷.可用如下流程来制备.

根据题意完成下列各题:
1.若用铁和稀硫酸制备FeSO4·7H2O________(填物质名称)往往要过量,理由是________.
2.要从溶液中得到绿矾,必须进行的实验操作是________.(按前后顺序填)
a.过滤洗涤
b.蒸发浓缩
c.冷却结晶
d.灼烧
e.干燥
某课外化学兴趣小组为测定三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·3H2O)中铁元素含量,做了如下实验:
步骤一:称量5.000 g三草酸合铁酸钾晶体,配制成250 ml溶液.
步骤二:取所配溶液25.00 ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部被氧化成二氧化碳,同时,MnO-4.被还原成Mn2+.向反应后的溶液中加入一定量锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍里酸性.
步骤三:用0.010 mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02 ml,滴定中MnO4,被还原成Mn2+.
重复步骤二、步骤三操作,滴定消耗0.010 mol/L KMnO4溶液19.98 ml;
回答3-6小题:
3.配制三草酸合铁酸钾溶液需要使用的玻璃仪器除烧杯、玻璃棒以外还有________;主要操作步骤依次是:称量、________、转移、________、定容、摇匀.
4.加入锌粉的目的是________.
5.实验测得该晶体中铁的质量分数为________.在步骤二中,若加入的KMnO4的溶液的量不够,则测得的铁含量________.(选填“偏低”“偏高”“不变”)
6.某同学将8.74 g无水三草酸合铁酸钾(K3[Fe(C2O4)3])在一定条件下加热分解,所得固体的质量为5.42 g,同时得到密度为1.647 g/L(已折合成标准状况下)气体.研究固体产物得知,铁元素不可能以三价形式存在,而盐只有K2CO3.写出该分解反应的化学方程式________.
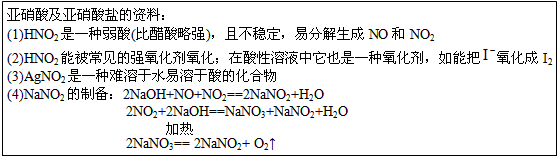
某同学查阅有关资料,了解到以下相关信息:
亚硝酸及亚硝酸盐的资料:
(1)HNO2是一种弱酸(比醋酸略强),且不稳定,易分解生成NO和NO2
(2)HNO2能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把氧化成I2
(3)AgNO2种难溶于水易溶于酸的化合物
(4)NaNO2制备:
2NaOH+NO+NO2═2NaNO2+H2O
2NO2+2NaOH═NaNO3+NaNO2+H2O
2NaNO3
| ||
试回答下列问题:
(1)人体正常的血红蛋白中应含Fe2+.若误食亚硝酸盐(如NaNO2),则导致血红蛋白中Fe2+转化为Fe3+而中毒,服用维生素C可解毒.下列叙述不正确的是
A.亚硝酸盐是还原剂 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐被还原
(2)下列方法中,不能用来区别NaNO2和NaCl的是
A.测定这两种溶液的pH
B.用AgNO3和HNO3两种试剂来区别
C.在酸性条件下加入KI淀粉试液来区别
D.分别在这两种溶液中滴加甲基橙
(3)为了测定某样品中NaNO2的含量,可以使用标准KMnO4溶液进行滴定,试回答:
①KMnO4溶液在滴定过程中作
②若滴定终点读数时目光俯视,则所得结果
(4)某同学在家中欲进行鉴别NaCl与NaNO2的实验,但他家中只有浓醋酸,请问该实验能否成功?说明理由.
(5)现有氮的三种常见氧化物组成的混和气体44.8L(体积已换算成标准状态),其中N2O4、NO体积分数都为20%.
①将该气体通入适量的NaOH溶液中恰好反应,则溶液中NaNO2的质量是
②反应后的溶液蒸干灼烧则NaNO2物质的量
(1)人体正常的血红蛋白中应含Fe2+,若误食亚硝酸盐(如NaNO2),则导致血红蛋白中Fe2+转化为
Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是________.
A.亚硝酸盐是还原剂 B.维生素C是还原剂 C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐被还原
(2)下列方法中,不能用来区别NaNO2和NaCl的是________.
A.测定这两种溶液的pH
B.用AgNO3和HNO3两种试剂来区别
C.在酸性条件下加入KI淀粉试液来区别
D.分别在这两种溶液中滴加甲基橙
(3)为了测定某样品中NaNO2的含量,可以使用标准KMnO4溶液进行滴定,试回答:
①KMnO4溶液在滴定过程中作________(填“氧化剂” “还原剂”),该滴定过程________(填“要”或“不要”)另加指示剂。
②若滴定终点读数时目光俯视,则所得结果________(填“偏大”“偏小”“无影响”)。
(4)某同学在家中欲进行鉴别NaCl与NaNO2的实验,但他家中只有浓醋酸,请问该实验能否成功?说明理由。_______________________________________
(5)现有氮的三种常见氧化物组成的混和气体44.8L(体积已换算成标准状态),其中N2O4、NO体积分数都为20%。
①将该气体通入适量的NaOH溶液中恰好反应,则溶液中NaNO2的质量是__________g;
②反应后的溶液蒸干灼烧则NaNO2物质的量__________mol。