题目内容
在氮的化合物中,有一类盐叫亚硝酸盐.如亚硝酸钠(NaNO2)等.它们广泛用于印染、漂白等行业,在建筑行业用作防冻剂,在食品工业作防腐剂和增色剂;它是一种潜在致癌物质,过量或长期食用对人产生危害,由于亚硝酸钠有咸味,外观与NaCl相似,曾多次发生过被误当食盐食用的事件.某同学查阅有关资料,了解到以下相关信息:
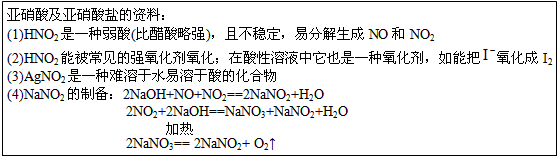
亚硝酸及亚硝酸盐的资料:
(1)HNO2是一种弱酸(比醋酸略强),且不稳定,易分解生成NO和NO2
(2)HNO2能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把氧化成I2
(3)AgNO2种难溶于水易溶于酸的化合物
(4)NaNO2制备:
2NaOH+NO+NO2═2NaNO2+H2O
2NO2+2NaOH═NaNO3+NaNO2+H2O
2NaNO3
| ||
试回答下列问题:
(1)人体正常的血红蛋白中应含Fe2+.若误食亚硝酸盐(如NaNO2),则导致血红蛋白中Fe2+转化为Fe3+而中毒,服用维生素C可解毒.下列叙述不正确的是
A.亚硝酸盐是还原剂 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐被还原
(2)下列方法中,不能用来区别NaNO2和NaCl的是
A.测定这两种溶液的pH
B.用AgNO3和HNO3两种试剂来区别
C.在酸性条件下加入KI淀粉试液来区别
D.分别在这两种溶液中滴加甲基橙
(3)为了测定某样品中NaNO2的含量,可以使用标准KMnO4溶液进行滴定,试回答:
①KMnO4溶液在滴定过程中作
②若滴定终点读数时目光俯视,则所得结果
(4)某同学在家中欲进行鉴别NaCl与NaNO2的实验,但他家中只有浓醋酸,请问该实验能否成功?说明理由.
(5)现有氮的三种常见氧化物组成的混和气体44.8L(体积已换算成标准状态),其中N2O4、NO体积分数都为20%.
①将该气体通入适量的NaOH溶液中恰好反应,则溶液中NaNO2的质量是
②反应后的溶液蒸干灼烧则NaNO2物质的量
分析:(1)由题给信息可知Fe2+转化为Fe3+而中毒,服用维生素C可以解毒,说明在维生素C作用下Fe3+又转化为Fe2+;
(2)A、亚硝酸钠是强碱弱酸盐其水溶液呈碱性,氯化钠是强酸强碱盐其水溶液呈中性;
B、亚硝酸根离子不和银离子反应,氯离子和银离子反应生成白色沉淀;
C、酸性条件下,亚硝酸根离子能被碘离子还原生成一氧化氮,同时生成碘单质;
D、甲基橙的变色范围是3.1-4.4;
(3)①根据高锰酸钾溶液具有强氧化性判断;根据高锰酸钾溶液溶液为有色溶液分析是否使用指示剂;
②俯视读数,导致消耗的高锰酸钾溶液体积偏小;
(4)根据浓醋酸酸性与亚硝酸酸性关系及亚硝酸的容易分解的性质进行分析;
(5)①根据标况下气体摩尔体积计算出混合气体的物质的量,然后根据N2O4、NO体积分数都为20%计算出N2O4、NO和二氧化氮的物质的量,再根据反应计算出生成亚硝酸钠的物质的量及质量;
②由于反应2NaNO3
2NaNO2+O2↑,灼烧溶液最后所有的氮原子都转化成了亚硝酸钠,可以根据氮原子守恒计算出生成亚硝酸钠的物质的量.
(2)A、亚硝酸钠是强碱弱酸盐其水溶液呈碱性,氯化钠是强酸强碱盐其水溶液呈中性;
B、亚硝酸根离子不和银离子反应,氯离子和银离子反应生成白色沉淀;
C、酸性条件下,亚硝酸根离子能被碘离子还原生成一氧化氮,同时生成碘单质;
D、甲基橙的变色范围是3.1-4.4;
(3)①根据高锰酸钾溶液具有强氧化性判断;根据高锰酸钾溶液溶液为有色溶液分析是否使用指示剂;
②俯视读数,导致消耗的高锰酸钾溶液体积偏小;
(4)根据浓醋酸酸性与亚硝酸酸性关系及亚硝酸的容易分解的性质进行分析;
(5)①根据标况下气体摩尔体积计算出混合气体的物质的量,然后根据N2O4、NO体积分数都为20%计算出N2O4、NO和二氧化氮的物质的量,再根据反应计算出生成亚硝酸钠的物质的量及质量;
②由于反应2NaNO3
| ||
解答:解:(1)服用维生素C可以解毒,说明在维生素C作用下Fe3+又转化为Fe2+,Fe元素化合价降低,被氧化,则维生素具有还原性,而亚硝酸盐,会导致Fe2+转化为Fe3+,说明亚硝酸盐具有氧化性,在反应中为氧化剂,所以维生素C是还原剂,
故选A;
(2)A、亚硝酸钠是强碱弱酸盐其水溶液呈碱性,氯化钠是强酸强碱盐其水溶液呈中性,相同物质的量浓度的两种溶液的pH不同,所以可以用测定这两种溶液的pH值鉴别,故A错误;
B、亚硝酸根离子不和银离子反应,氯离子和银离子反应生成不溶于硝酸的白色沉淀,反应现象不同,所以可以用AgNO3和HNO3两种试剂来区别,故B错误;
C、在酸性条件下,亚硝酸钠和碘离子反应方程式为2NO2-+2I-+4H+=2NO↑+I2+2H2O,碘遇淀粉变蓝色,氯离子和碘离子不反应,所以反应现象不同,所以可以用酸性条件下的KI淀粉试液来区别,故C错误;
D、亚硝酸钠是强碱弱酸盐其水溶液呈碱性,氯化钠是强酸强碱盐其水溶液呈中性,甲基橙的变色范围是3.1-4.4,所以亚硝酸钠和氯化钠溶液加入甲基橙后溶液都呈黄色,反应现象相同,所以不能用甲基橙鉴别,故D正确;
故选D;
(3)①高锰酸钾溶液具有强氧化性,而HNO2能被常见的强氧化剂氧化,所以KMnO4溶液在滴定过程中作氧化剂;高锰酸钾溶液为紫色溶液,滴定过程中不需要选用指示剂,可以根据滴入高锰酸钾溶液溶液后混合液的颜色变化判断滴定终点,
故答案为:氧化剂;不要;
②滴定终点读数时目光俯视,导致消耗高锰酸钾溶液体积读数偏小,测定结果偏低,
故答案为:偏小;
(4)HNO2不稳定,易分解生成NO和NO2,浓醋酸酸性强于亚硝酸,生成的HNO2分解为红棕色NO2气体,可以用浓醋酸鉴别氯化钠也亚硝酸钠,
答:能,强酸制取弱酸,生成的HNO2分解为红棕色NO2气体;
(5)①标况下44.8L混合气体含有气体的物质的量为:
=2mol,N2O4、NO体积分数都为20%,二氧化氮体积分数为60%,相同条件下体积之比就等于气体的物质的量之比,n(N2O4):n(NO):n(NO2)=1:1:3,n(N2O4)=n(NO)=2mol×
=0.4mol,n(NO2)=2mol×
=1.2mol,
由于存在可逆反应:N2O4?2NO2,在氢氧化钠溶液中,四氧化二氮完全转化成二氧化氮,所以混合气体中相当于存在二氧化氮的物质的量为:0.4mol×2+1.2mol=2mol;由反应2NaOH+NO+NO2═2NaNO2+H2O、2NO2+2NaOH═NaNO3+NaNO2+H2O可知,生成亚硝酸钠的物质的量为:n(NaNO2)=2n(NO)+
×(2mol-0.4mol)=0.8mol+0.8mol=1.6mol,生成的亚硝酸钠的质量为:m(NaNO2)=69g/mol×1.6mol=110.4g,
故答案为:110.4;
②反应后的溶液蒸干灼烧,硝酸钠转化成了亚硝酸钠,根据题中反应可知,所有的混合气体中的氮原子都转化成了亚硝酸钠,
即n(NaNO2)=n(N)=2n(N2O4)+n(NO)+n(NO2)=0.4mol×2+0.4mol+1.2mol=2.4mol,
故答案为:2.4.
故选A;
(2)A、亚硝酸钠是强碱弱酸盐其水溶液呈碱性,氯化钠是强酸强碱盐其水溶液呈中性,相同物质的量浓度的两种溶液的pH不同,所以可以用测定这两种溶液的pH值鉴别,故A错误;
B、亚硝酸根离子不和银离子反应,氯离子和银离子反应生成不溶于硝酸的白色沉淀,反应现象不同,所以可以用AgNO3和HNO3两种试剂来区别,故B错误;
C、在酸性条件下,亚硝酸钠和碘离子反应方程式为2NO2-+2I-+4H+=2NO↑+I2+2H2O,碘遇淀粉变蓝色,氯离子和碘离子不反应,所以反应现象不同,所以可以用酸性条件下的KI淀粉试液来区别,故C错误;
D、亚硝酸钠是强碱弱酸盐其水溶液呈碱性,氯化钠是强酸强碱盐其水溶液呈中性,甲基橙的变色范围是3.1-4.4,所以亚硝酸钠和氯化钠溶液加入甲基橙后溶液都呈黄色,反应现象相同,所以不能用甲基橙鉴别,故D正确;
故选D;
(3)①高锰酸钾溶液具有强氧化性,而HNO2能被常见的强氧化剂氧化,所以KMnO4溶液在滴定过程中作氧化剂;高锰酸钾溶液为紫色溶液,滴定过程中不需要选用指示剂,可以根据滴入高锰酸钾溶液溶液后混合液的颜色变化判断滴定终点,
故答案为:氧化剂;不要;
②滴定终点读数时目光俯视,导致消耗高锰酸钾溶液体积读数偏小,测定结果偏低,
故答案为:偏小;
(4)HNO2不稳定,易分解生成NO和NO2,浓醋酸酸性强于亚硝酸,生成的HNO2分解为红棕色NO2气体,可以用浓醋酸鉴别氯化钠也亚硝酸钠,
答:能,强酸制取弱酸,生成的HNO2分解为红棕色NO2气体;
(5)①标况下44.8L混合气体含有气体的物质的量为:
| 44.8L |
| 22.4L/mol |
| 1 |
| 5 |
| 3 |
| 5 |
由于存在可逆反应:N2O4?2NO2,在氢氧化钠溶液中,四氧化二氮完全转化成二氧化氮,所以混合气体中相当于存在二氧化氮的物质的量为:0.4mol×2+1.2mol=2mol;由反应2NaOH+NO+NO2═2NaNO2+H2O、2NO2+2NaOH═NaNO3+NaNO2+H2O可知,生成亚硝酸钠的物质的量为:n(NaNO2)=2n(NO)+
| 1 |
| 2 |
故答案为:110.4;
②反应后的溶液蒸干灼烧,硝酸钠转化成了亚硝酸钠,根据题中反应可知,所有的混合气体中的氮原子都转化成了亚硝酸钠,
即n(NaNO2)=n(N)=2n(N2O4)+n(NO)+n(NO2)=0.4mol×2+0.4mol+1.2mol=2.4mol,
故答案为:2.4.
点评:本题考查了亚硝酸钠的性质,题目难度中等,涉及了铁盐和亚铁盐的相互转化、亚硝酸盐的性质等知识,注意掌握二价铁离子和三价铁离子的检验方法,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
相关题目
| |||||||||||||||||||||||||||||||||||||||