摘要:6.已知在25℃.101k Pa下.1g C8H18燃烧生成二氧化碳和液态水时放出48.40 kJ的热量.表示上述反应的热化学方程式正确的是 A.C8H18(l)+O2(g)===8CO2(g)+9H2O(g),△H= -48.40 kJ·mol-1 B.C8H18(l)+O2(g)===8CO2(g)+9H2O(l),△H= -5518 kJ·mol-1 C.C8H18(l)+O2(g)===8CO2(g)+9H2O(l),△H= +5518 kJ·mol-1 D.C8H18(l)+O2(g)===8CO2(g)+9H2O(l),△H= -48.40 kJ·mol-1
网址:http://m.1010jiajiao.com/timu3_id_264142[举报]
已知在25℃,101K Pa下,1g C8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40KJ热量。表示上述反应的热化学方程式正确的是
- A.C8H18(l)+12.5O2(g)== 8CO2(g)+ 9H2O(g) ΔH= ? 48.40KJ/mol
- B.C8H18(l)+12.5O2(g)== 8CO2(g)+ 9H2O(l) ΔH= ? 5518KJ/mol
- C.C8H18(l)+12.5O2(g)== 8CO2(g)+ 9H2O(l) ΔH= +5518KJ/mol
- D.C8H18(l)+12.5O2(g)== 8CO2(g)+ 9H2O(l) ΔH= ? 48.40KJ/mol
X、Y、Z、Q、T五种元素位于前四周期,且原子序数依次增大.X、Y的单质在常温常压下呈气态,X形成的单质分子中无孤电子对,Y的基态原子中能级上有两个未成对电子.Z原子的半径在同周期主族元素中最大.Q的氧化物是形成酸雨的一种主要物质.T2+所含有的电子数等于Z原子与Q原子的电子数之和.
(1)Q元素位于元素周期表第 周期 族,T2+的电子排布式为 .
(2)Y元素和Q元素分别形成的组成相似的氢化物中,沸点最高的是 .(写出化学式)原因是 .用惰性电极电解X、Y、Z三种元素形成的化合物水溶液,其阳极的电极反应式为 .
(3)Z与Q形成的化合物的水溶液呈 (填“酸性”、“中性”、“碱性”)原因是 (用离子方程式表示)
(4)已知在25℃、101325Pa时:
2T(s)+Q(s)=T2Q(s)△H=-79.5KJ/mol
Q(s)+Y2(g)=QY2(g)△H=-296.6KJ/mol
根据上述反应,请写出T2Q与Y2反应生成T与QY2的热化学方程式 .
查看习题详情和答案>>
(1)Q元素位于元素周期表第
(2)Y元素和Q元素分别形成的组成相似的氢化物中,沸点最高的是
(3)Z与Q形成的化合物的水溶液呈
(4)已知在25℃、101325Pa时:
2T(s)+Q(s)=T2Q(s)△H=-79.5KJ/mol
Q(s)+Y2(g)=QY2(g)△H=-296.6KJ/mol
根据上述反应,请写出T2Q与Y2反应生成T与QY2的热化学方程式
 A、B、X、Y、Z是五种常见的短周期元素,其原子半径随原子序数的变化如图所示.已知A是地壳中含量最高的元素;B和Ne原子的质子数相差l;X在空气中燃烧可生成两种化合物;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.请回答下列问题:
A、B、X、Y、Z是五种常见的短周期元素,其原子半径随原子序数的变化如图所示.已知A是地壳中含量最高的元素;B和Ne原子的质子数相差l;X在空气中燃烧可生成两种化合物;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.请回答下列问题:(1)Y的原子结构示意图为
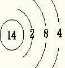

第三周期ⅤⅡA族
第三周期ⅤⅡA族
.(2)A与B的单质在不同条件下反应,生成物的化学式分别为
Na2O、Na2O2
Na2O、Na2O2
.(3)CH3XZ是一种重要的有机合成试剂,该化合物水解可生成最简单的有机物和一种碱式盐,有关反应的化学方程式为
CH3MgCl+H2O═CH4↑+Mg(OH)Cl
CH3MgCl+H2O═CH4↑+Mg(OH)Cl
.(4)已知在25℃、101kPa下,Y的气态氢化物在氧气中完全燃烧生成其对应的氧化物,恢复至原状态,已知每转移lmol电子时放热190.0kJ,则0.5mol该气态氢化物完全燃烧时放出热量为
760.0kJ
760.0kJ
kJ. 肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.(1)已知在25℃,101kPa时,16.0g N2H4在氧气中完全燃烧生成氮气,放出热量312kJ,N2H4完全燃烧反应的热化学方程式是
N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol
N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol
.肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.肼-空气燃料电池放电时,负极的电极反应式是:N2H4+4OH--4e-=4H2O+N2
N2H4+4OH--4e-=4H2O+N2
.电池工作一段时间后,电解质溶液的pH将减小
减小
(填“增大”、“减小”、“不变”).(2)如图是一个电化学装置示意图.用肼--空气燃料电池做此装置的电源.如果A是铂电极,B是石墨电极,C是500mL足量的饱和氯化钠溶液,当两极共产生1.12L气体时,溶液的pH为
13
13
,则肼-空气燃料电池理论上消耗的空气1.4
1.4
L(气体体积在标准状况下测定,假设空气中氧气体积分数为20%)(3)肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因
N2H4+H2O=N2H5++OH-;N2H5++H2O=N2H62++OH-
N2H4+H2O=N2H5++OH-;N2H5++H2O=N2H62++OH-
.(4)常温下将0.2mol/L HCl溶液与0.2mol/L N2H4?H2O溶液等体积混合(忽略混合后溶液体积的变化),若测得混合溶液的pH=6,则混合溶液中由水电离出的c(H+)
大于
大于
0.1mol/L HCl溶液中由水电离出的c(H+)(填“大于”、“小于”、或“等于”).(5)已知:在相同条件下N2H4?H2O的电离程度大于N2H5C1的水解程度.常温下,若将0.2mol/L N2H4?H2O溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H+5、Cl-、OH-、H+离子浓度由大到小的顺序为
c(N2H5+)>c(Cl-)>c(OH-)>c(H+)
c(N2H5+)>c(Cl-)>c(OH-)>c(H+)
.