题目内容
 A、B、X、Y、Z是五种常见的短周期元素,其原子半径随原子序数的变化如图所示.已知A是地壳中含量最高的元素;B和Ne原子的质子数相差l;X在空气中燃烧可生成两种化合物;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.请回答下列问题:
A、B、X、Y、Z是五种常见的短周期元素,其原子半径随原子序数的变化如图所示.已知A是地壳中含量最高的元素;B和Ne原子的质子数相差l;X在空气中燃烧可生成两种化合物;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.请回答下列问题:(1)Y的原子结构示意图为

第三周期ⅤⅡA族
第三周期ⅤⅡA族
.(2)A与B的单质在不同条件下反应,生成物的化学式分别为
Na2O、Na2O2
Na2O、Na2O2
.(3)CH3XZ是一种重要的有机合成试剂,该化合物水解可生成最简单的有机物和一种碱式盐,有关反应的化学方程式为
CH3MgCl+H2O═CH4↑+Mg(OH)Cl
CH3MgCl+H2O═CH4↑+Mg(OH)Cl
.(4)已知在25℃、101kPa下,Y的气态氢化物在氧气中完全燃烧生成其对应的氧化物,恢复至原状态,已知每转移lmol电子时放热190.0kJ,则0.5mol该气态氢化物完全燃烧时放出热量为
760.0kJ
760.0kJ
kJ.分析:A、B、X、Y、Z是五种常见的短周期元素,A是地壳中含量最高的元素,则A为O;B和Ne原子的质子数相差l,且B的原子半径最大,则B为Na;X在空气中燃烧可生成两种化合物,则X为Mg;Y的单质是一种常见的半导体材料,则Y为Si;Z的非金属性在同周期元素中最强,且Z的原子半径大于A,则Z为第三周期的Cl,然后结合化学用语来解答.
解答:解:A、B、X、Y、Z是五种常见的短周期元素,A是地壳中含量最高的元素,则A为O;B和Ne原子的质子数相差l,且B的原子半径最大,则B为Na;X在空气中燃烧可生成两种化合物,则X为Mg;Y的单质是一种常见的半导体材料,则Y为Si;Z的非金属性在同周期元素中最强,且Z的原子半径大于A,则Z为第三周期的Cl,
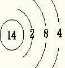
(1)Y为Si,质子数为14,其原子结构示意图为 ,Z在第三周期ⅤⅡA族,故答案为:
,Z在第三周期ⅤⅡA族,故答案为: ;第三周期ⅤⅡA族;
;第三周期ⅤⅡA族;
(2)Na与氧气在常温下反应生成Na2O,在加热或点燃时生成Na2O2,故答案为:Na2O、Na2O2;
(3)CH3MgCl水解可生成最简单的有机物和一种碱式盐,则该反应的化学方程式为CH3MgCl+H2O═CH4↑+Mg(OH)Cl,
故答案为:CH3MgCl+H2O═CH4↑+Mg(OH)Cl;
(4)由SiH4+2O2
SiO2+2H2O,每转移lmol电子时放热190.0kJ,该反应中Si元素由-4价升高到+4价,则转移8mol电子时放出190.0kJ×8=1520kJ,
即1mol该气态氢化物完全燃烧时放出热量为1520kJ,所以0.5mol该气态氢化物完全燃烧时放出热量为0.5×1520=760.0kJ,故答案为:760.0.
(1)Y为Si,质子数为14,其原子结构示意图为
 ,Z在第三周期ⅤⅡA族,故答案为:
,Z在第三周期ⅤⅡA族,故答案为: ;第三周期ⅤⅡA族;
;第三周期ⅤⅡA族;(2)Na与氧气在常温下反应生成Na2O,在加热或点燃时生成Na2O2,故答案为:Na2O、Na2O2;
(3)CH3MgCl水解可生成最简单的有机物和一种碱式盐,则该反应的化学方程式为CH3MgCl+H2O═CH4↑+Mg(OH)Cl,
故答案为:CH3MgCl+H2O═CH4↑+Mg(OH)Cl;
(4)由SiH4+2O2
| ||
即1mol该气态氢化物完全燃烧时放出热量为1520kJ,所以0.5mol该气态氢化物完全燃烧时放出热量为0.5×1520=760.0kJ,故答案为:760.0.
点评:本题考查元素周期律和元素周期表,元素的推断是解答本题的关键,并熟悉常见元素的性质、化学用语、化学反应与能量等知识来解答,(3)为解答的难点,题目难度中等.

练习册系列答案
相关题目




