摘要:汽车的启动电源常用铅蓄电池.电池反应如下: PbO2 + Pb + 2H2SO4 2PbSO4+ 2H2O.根据此反应判断下列叙述中正确的是 A.PbO2放电时是电池的负极.充电时是电池的阳极. B.负极的电极反应式为:Pb + SO– 2e – = PbSO4 C.放电时.PbO2得电子.被氧化 D.电池放电时.溶液酸性增强
网址:http://m.1010jiajiao.com/timu3_id_258536[举报]
| |||||||||||||||
汽车的启动电源常用铅蓄电池,电池反应如下:
PbO2 + Pb + 2H2SO4 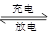 2PbSO4+ 2H2O,根据此反应判断下列叙述中正确的是( )
2PbSO4+ 2H2O,根据此反应判断下列叙述中正确的是( )
| A.PbO2放电时是电池的负极,充电时是电池的阳极。 |
B.负极的电极反应式为:Pb + SO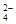 – 2e – = PbSO4 – 2e – = PbSO4 |
| C.放电时,PbO2得电子,被氧化 |
| D.电池放电时,溶液酸性增强 |
汽车的启动电源常用铅蓄电池,电池反应如下:
PbO2 + Pb + 2H2SO4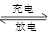 2PbSO4+ 2H2O,根据此反应判断下列叙述中正确的是( )
2PbSO4+ 2H2O,根据此反应判断下列叙述中正确的是( )
PbO2 + Pb + 2H2SO4
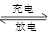 2PbSO4+ 2H2O,根据此反应判断下列叙述中正确的是( )
2PbSO4+ 2H2O,根据此反应判断下列叙述中正确的是( )| A.PbO2放电时是电池的负极,充电时是电池的阳极。 |
B.负极的电极反应式为:Pb + SO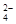 – 2e – = PbSO4 – 2e – = PbSO4 |
| C.放电时,PbO2得电子,被氧化 |
| D.电池放电时,溶液酸性增强 |