摘要:海洋是巨大的资源宝库.从海洋中可提取许多重要物质.请你参与下列探究活动并完成有关问题: (1)我市某盐场测得:①海水含NaCl约为3.5%,(即指溶质氯化钠的质量占整个溶液中质量的百分比为3.5%.下同)②在海边打深井,③井水中含NaCl约为8%.晒盐最好选择 作原料.理由是 . (2)关于晒盐原理的说法正确的是 . A.利用阳光和风力.使氯化钠蒸发出来 B.利用阳光和风力.使水分蒸发.析出食盐 C.降低温度使氯化钠析出 D.日光照晒后.氯化钠的溶解度变小 (3)晒盐后得到的母液中含有氯化镁(MgCl2).硫酸镁(MgSO4)和氯化钾(KCl)等物质.参照图中各物质的溶解度曲线.从卤水中提取氯化钾晶体可采用下列方法: ①将卤水加热到60 ℃以上蒸发水分后.会逐渐析出 晶体.其理由是 . ②将①中的晶体过滤后.得到滤液.把滤液降温至30℃以下.又析出氯化钾晶体.然后用少量的 洗涤这两种晶体的混合物.就可以得到较纯的氯化钾晶体. 解析:氯化钠的溶解度受温度影响变化不大.应采用蒸发水分离出晶体.根据曲线图对比几种物质溶解度曲线的不同点后再进行判断. 答案:(1)② NaCl的质量分数大.经土层过滤后污染小 (2)B (3)①硫酸镁 温度高于60 ℃后硫酸镁的溶解度随温度升高而减小 ②冷水
网址:http://m.1010jiajiao.com/timu3_id_25070[举报]
海洋是个巨大的宝库,为人类提供了宝贵的自然资源.
(1)食用海鱼摄取的主要营养素是
(2)如图1为海水淡化装置,利用的能源是
A.单质 B.化合物 C.混合物
(3)利用海水可制取许多化工产品.用海水制食盐,常通过海水晒盐得到粗盐,粗盐中含有少量的CaCl2、Na2SO4等杂质.除去上述杂质,先加过量的BaCl2溶液除去,再加过量
(4)用氯化钠和碳酸氢铵可制备碳酸氢钠和氯化铵,该反应化学方程式可表示为;NaCl+NH4HCO3=NaHCO3+NH4Cl.20℃时,按上述化学方程式中反应物的质量比,向100克水中加入11.7克NaCl和15.8克NH4HCO3,理论上从溶液中提出晶体的质量为
资料:20℃时四种物质的溶解度如下:假设它们同时溶解在水中各自的溶解度不变,
(5)从海水中提取溴常用吹出法,即用氯气将海水里的溴化钠中的溴置换出来,再用空气或水蒸气吹出溴.流程示意图如图2:
①写出氯气置换出溴单质的化学方程式;
②吹出的溴和大量空气混合在一起进入吸收塔(吸收塔中发生的反应;Br2+SO2+2H2O?H2SO4+2HBr).根据流程图分析,通入SO2的目的是

查看习题详情和答案>>
(1)食用海鱼摄取的主要营养素是
蛋白质
蛋白质
.(2)如图1为海水淡化装置,利用的能源是
太阳能
太阳能
,获得的蒸馏水属于B
B
.A.单质 B.化合物 C.混合物
(3)利用海水可制取许多化工产品.用海水制食盐,常通过海水晒盐得到粗盐,粗盐中含有少量的CaCl2、Na2SO4等杂质.除去上述杂质,先加过量的BaCl2溶液除去,再加过量
Na2CO3
Na2CO3
溶液除去CaCl2和过量的BaCl2,生成的沉淀经CaCO3、BaCO3
CaCO3、BaCO3
除去,最后加入稀盐酸
稀盐酸
调节pH,蒸发、结晶,制得粗盐.(4)用氯化钠和碳酸氢铵可制备碳酸氢钠和氯化铵,该反应化学方程式可表示为;NaCl+NH4HCO3=NaHCO3+NH4Cl.20℃时,按上述化学方程式中反应物的质量比,向100克水中加入11.7克NaCl和15.8克NH4HCO3,理论上从溶液中提出晶体的质量为
7.2
7.2
g.资料:20℃时四种物质的溶解度如下:假设它们同时溶解在水中各自的溶解度不变,
| 物质 | NaCl | NH4CO3 | NH4Cl | NaHCO3 |
| 溶解度 | 36.0 | 21.6 | 37.2 | 9.6 |
①写出氯气置换出溴单质的化学方程式;
Cl2+2NaBr=2NaCl+Br2
Cl2+2NaBr=2NaCl+Br2
;该反应在pH=3的酸性条件下进行,可用pH试纸
pH试纸
测定反应液的酸碱度.②吹出的溴和大量空气混合在一起进入吸收塔(吸收塔中发生的反应;Br2+SO2+2H2O?H2SO4+2HBr).根据流程图分析,通入SO2的目的是
分离溴与空气
分离溴与空气
.
海洋是个巨大的资源宝库,利用海水可制取许多化工产品.
(1)用海水提取氯化钠,常先通过蒸发除水得到粗盐,再除去泥沙可得到精盐,精盐中仍含有少量的CaCl2、Na2SO4杂质.除去精盐中的上述杂质,可先加入过量
(2)从海水中提取溴常用吹出法,即用氯气(C12)将海水里溴化钠(NaBr)中的溴置换出来,再用空气吹出溴(Br2).流程示意图如下:

①写出氯气从NaBr中置换出溴单质的化学方程式:
②吹出的溴和大量空气混合在一起进入吸收塔(吸收塔中发生的反应:Br2+SO2+2H2O=H2SO4+2HBr).根据流程图分析,通入SO2和水的目的是
查看习题详情和答案>>
(1)用海水提取氯化钠,常先通过蒸发除水得到粗盐,再除去泥沙可得到精盐,精盐中仍含有少量的CaCl2、Na2SO4杂质.除去精盐中的上述杂质,可先加入过量
BaCl2
BaCl2
溶液,再加入过量的Na2CO3
Na2CO3
溶液,然后再经过滤,滤掉的沉淀中含有BaSO4、BaCO3和CaCO3
BaSO4、BaCO3和CaCO3
、滴加适量的盐酸
盐酸
、蒸发,即可得到纯净的氯化钠.(2)从海水中提取溴常用吹出法,即用氯气(C12)将海水里溴化钠(NaBr)中的溴置换出来,再用空气吹出溴(Br2).流程示意图如下:

①写出氯气从NaBr中置换出溴单质的化学方程式:
Cl2+2NaBr=2NaCl+Br2
Cl2+2NaBr=2NaCl+Br2
;该反应在pH=3的酸性条件下进行,可用pH试纸
pH试纸
测定反应液的酸碱度.②吹出的溴和大量空气混合在一起进入吸收塔(吸收塔中发生的反应:Br2+SO2+2H2O=H2SO4+2HBr).根据流程图分析,通入SO2和水的目的是
使Br2转化为HBr使溴与空气相互分离
使Br2转化为HBr使溴与空气相互分离
.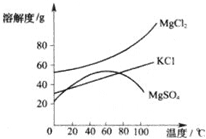 海洋是巨大的资源宝库,从海洋中可提取许多重要物质.请你参与下列问题的讨论:
海洋是巨大的资源宝库,从海洋中可提取许多重要物质.请你参与下列问题的讨论:(1)我市某盐场测得:
①海水中含NaCl约为3.5%;
②在海边打深井,井水中含NaCl约为8%.
晒盐最好用
(2)关于晒盐原理的说法正确的是
A.利用阳光和风力,使水分蒸发,析出盐
B.日光照晒后,氯化钠的溶解度变小
(3)晒盐后得到的母液(又称卤水)中含有氯化镁(MgCl2)、硫酸镁(MgSO4)和氯化钾(KCl)等物质.参照如图各物质的溶解度曲线,从卤水中提取KCl晶体采用下列方法:
①将卤水加热到60℃以上蒸发水分就会逐渐析出
②将①中的晶体过滤后,得到滤液,将它降温到30℃以下,又析出晶体氯化镁和氯化钾,然后用少量的
海洋是个巨大的宝库,为人类提供了宝贵的自然资源.
(1)食用海鱼摄取的主要营养素是________.
(2)如图1为海水淡化装置,利用的能源是________,获得的蒸馏水属于________.
A.单质 B.化合物 C.混合物
(3)利用海水可制取许多化工产品.用海水制食盐,常通过海水晒盐得到粗盐,粗盐中含有少量的CaCl2、Na2SO4等杂质.除去上述杂质,先加过量的BaCl2溶液除去,再加过量________溶液除去CaCl2和过量的BaCl2,生成的沉淀经________除去,最后加入________调节pH,蒸发、结晶,制得粗盐.
(4)用氯化钠和碳酸氢铵可制备碳酸氢钠和氯化铵,该反应化学方程式可表示为;NaCl+NH4HCO3=NaHCO3+NH4Cl.20℃时,按上述化学方程式中反应物的质量比,向100克水中加入11.7克NaCl和15.8克NH4HCO3,理论上从溶液中提出晶体的质量为________g.
资料:20℃时四种物质的溶解度如下:假设它们同时溶解在水中各自的溶解度不变,
| 物质 | NaCl | NH4CO3 | NH4Cl | NaHCO3 |
| 溶解度 | 36.0 | 21.6 | 37.2 | 9.6 |
①写出氯气置换出溴单质的化学方程式;________;该反应在pH=3的酸性条件下进行,可用________测定反应液的酸碱度.
②吹出的溴和大量空气混合在一起进入吸收塔(吸收塔中发生的反应;Br2+SO2+2H2O?H2SO4+2HBr).根据流程图分析,通入SO2的目的是________.
 查看习题详情和答案>>
查看习题详情和答案>>
 海洋是巨大的资源宝库,从海洋中可提取许多重要物质.请你参与下列探究活动并完成有关问题:
海洋是巨大的资源宝库,从海洋中可提取许多重要物质.请你参与下列探究活动并完成有关问题: