题目内容
 海洋是巨大的资源宝库,从海洋中可提取许多重要物质.请你参与下列问题的讨论:
海洋是巨大的资源宝库,从海洋中可提取许多重要物质.请你参与下列问题的讨论:(1)我市某盐场测得:
①海水中含NaCl约为3.5%;
②在海边打深井,井水中含NaCl约为8%.
晒盐最好用
(2)关于晒盐原理的说法正确的是
A.利用阳光和风力,使水分蒸发,析出盐
B.日光照晒后,氯化钠的溶解度变小
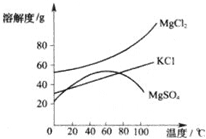
(3)晒盐后得到的母液(又称卤水)中含有氯化镁(MgCl2)、硫酸镁(MgSO4)和氯化钾(KCl)等物质.参照如图各物质的溶解度曲线,从卤水中提取KCl晶体采用下列方法:
①将卤水加热到60℃以上蒸发水分就会逐渐析出
②将①中的晶体过滤后,得到滤液,将它降温到30℃以下,又析出晶体氯化镁和氯化钾,然后用少量的
分析:(1)根据①②两种溶液氯化钠的含量分析即可;
(2)根据晒盐的原理分析即可;
(3)①根据氯化镁(MgCl2)、硫酸镁(MgSO4)和氯化钾(KCl)三种物质的溶解度与温度的变化关系分析即可;
②根据晶体洗涤的正确方法分析即可.
(2)根据晒盐的原理分析即可;
(3)①根据氯化镁(MgCl2)、硫酸镁(MgSO4)和氯化钾(KCl)三种物质的溶解度与温度的变化关系分析即可;
②根据晶体洗涤的正确方法分析即可.
解答:解:(1)因为②的氯化钠含量高,且它是经过土层过滤的,污染更小;
(2)因为氯化钠的溶解度受温度影响比较小,所以用蒸发结晶的方法从海水中提取食盐;日晒后温度升高,氯化钠的溶解度略有升高;
(3)从溶解度曲线可知,温度高于60℃时,硫酸镁的溶解度随温度的升高而减小,故硫酸镁会析出.在低温时,KCl的溶解度比MgCl2小,因此用一定量的冷水洗涤晶体时,就可将MgCl2和杂质溶解除去,大部分KCl不溶解,成为较纯的KCl晶体.
答案:(1)②;(2)A;(3)①硫酸镁; ②冷水.
(2)因为氯化钠的溶解度受温度影响比较小,所以用蒸发结晶的方法从海水中提取食盐;日晒后温度升高,氯化钠的溶解度略有升高;
(3)从溶解度曲线可知,温度高于60℃时,硫酸镁的溶解度随温度的升高而减小,故硫酸镁会析出.在低温时,KCl的溶解度比MgCl2小,因此用一定量的冷水洗涤晶体时,就可将MgCl2和杂质溶解除去,大部分KCl不溶解,成为较纯的KCl晶体.
答案:(1)②;(2)A;(3)①硫酸镁; ②冷水.
点评:结晶分为冷却结晶和蒸发结晶,当溶质的溶解度受温度影响不大时用蒸发结晶的方法得到晶体;当溶质的溶解度受温度影响大时用冷却结晶的方法得到晶体.

练习册系列答案
 综合自测系列答案
综合自测系列答案
相关题目
 17、海洋是巨大的资源宝库,从海洋中可提取许多重要物质.请你参与下列探究活动并完成有关问题:
17、海洋是巨大的资源宝库,从海洋中可提取许多重要物质.请你参与下列探究活动并完成有关问题: 23、海洋是巨大的资源宝库,从海洋中可提取许多重要物质.请你参与下列探究活动并完成有关问题:
23、海洋是巨大的资源宝库,从海洋中可提取许多重要物质.请你参与下列探究活动并完成有关问题:
