题目内容
海洋是个巨大的资源宝库,利用海水可制取许多化工产品.
(1)用海水提取氯化钠,常先通过蒸发除水得到粗盐,再除去泥沙可得到精盐,精盐中仍含有少量的CaCl2、Na2SO4杂质.除去精盐中的上述杂质,可先加入过量
(2)从海水中提取溴常用吹出法,即用氯气(C12)将海水里溴化钠(NaBr)中的溴置换出来,再用空气吹出溴(Br2).流程示意图如下:

①写出氯气从NaBr中置换出溴单质的化学方程式:
②吹出的溴和大量空气混合在一起进入吸收塔(吸收塔中发生的反应:Br2+SO2+2H2O=H2SO4+2HBr).根据流程图分析,通入SO2和水的目的是
(1)用海水提取氯化钠,常先通过蒸发除水得到粗盐,再除去泥沙可得到精盐,精盐中仍含有少量的CaCl2、Na2SO4杂质.除去精盐中的上述杂质,可先加入过量
BaCl2
BaCl2
溶液,再加入过量的Na2CO3
Na2CO3
溶液,然后再经过滤,滤掉的沉淀中含有BaSO4、BaCO3和CaCO3
BaSO4、BaCO3和CaCO3
、滴加适量的盐酸
盐酸
、蒸发,即可得到纯净的氯化钠.(2)从海水中提取溴常用吹出法,即用氯气(C12)将海水里溴化钠(NaBr)中的溴置换出来,再用空气吹出溴(Br2).流程示意图如下:

①写出氯气从NaBr中置换出溴单质的化学方程式:
Cl2+2NaBr=2NaCl+Br2
Cl2+2NaBr=2NaCl+Br2
;该反应在pH=3的酸性条件下进行,可用pH试纸
pH试纸
测定反应液的酸碱度.②吹出的溴和大量空气混合在一起进入吸收塔(吸收塔中发生的反应:Br2+SO2+2H2O=H2SO4+2HBr).根据流程图分析,通入SO2和水的目的是
使Br2转化为HBr使溴与空气相互分离
使Br2转化为HBr使溴与空气相互分离
.分析:(1)依据海水晒盐的原理分析粗盐制得的方法,并依据BaCl2可以和硫酸钠反应以及碳酸钠可以和CaCl2反应生成氯化钠和碳酸钙,除掉不溶于水的杂质,再加入盐酸调节至中性;
(2)依据题干叙述书写氯气置换出溴单质的化学方程式,并根据常见的测定溶液酸碱度的方法测定溶液的酸碱度,依据吸收塔中发生的反应分析加入二氧化硫的目的;
(2)依据题干叙述书写氯气置换出溴单质的化学方程式,并根据常见的测定溶液酸碱度的方法测定溶液的酸碱度,依据吸收塔中发生的反应分析加入二氧化硫的目的;
解答:解:(1)海水晒盐的原理是通过蒸发海水制得粗盐,由于BaCl2可以和硫酸钠反应生成硫酸钡沉淀和氯化钠,以及碳酸钠可以和CaCl2反应生成氯化钠和碳酸钙,碳酸钠还与过量的氯化钡反应生成碳酸钡和氯化钠;过滤除去不溶于水的杂质,再滴加稀盐酸除掉过量的碳酸钠再进行蒸发结晶即可,最后得到氯化钠;
(2)依据题干叙述可知氯气和溴化钠可以置换出溴单质,反应物是氯气和溴化钠,生成物是氯化钠和溴,根据观察法配平即可,其化学方程式为:Cl2+2NaBr=2NaCl+Br2,常见的测定溶液酸碱度的方法是使用pH试纸测定溶液的酸碱度,由于吸收塔中发生的反应是Br2+S02+2H20═H2S04+2HBr所以加入二氧化硫的目的是使溴与空气相互分离;
故答案为:(1)BaCl2; Na2CO3; BaSO4、BaCO3和CaCO3 ;盐酸;(2)①Cl2+2NaBr=2NaCl+Br2;pH试纸;②使Br2转化为HBr使溴与空气相互分离.
(2)依据题干叙述可知氯气和溴化钠可以置换出溴单质,反应物是氯气和溴化钠,生成物是氯化钠和溴,根据观察法配平即可,其化学方程式为:Cl2+2NaBr=2NaCl+Br2,常见的测定溶液酸碱度的方法是使用pH试纸测定溶液的酸碱度,由于吸收塔中发生的反应是Br2+S02+2H20═H2S04+2HBr所以加入二氧化硫的目的是使溴与空气相互分离;
故答案为:(1)BaCl2; Na2CO3; BaSO4、BaCO3和CaCO3 ;盐酸;(2)①Cl2+2NaBr=2NaCl+Br2;pH试纸;②使Br2转化为HBr使溴与空气相互分离.
点评:此题是对海水相关问题的探讨,涉及到海水中杂质的除掉方法和原理,解题的关键是掌握溶液中杂质除掉的反应原理以及题干中有关信息使用.

练习册系列答案
相关题目
海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还含有大量的化学物质.Ⅰ.海水制溴.从海水中提取的溴约占世界溴产量的1/3,工业上常用“吹出法”制溴,其工艺流程如下: 试回答:
试回答:
(1)步骤②中的化学方程式为2NaBr+Cl2=2NaCl+Br2,其反应类型是 .
(2)非金属单质也具有类似金属与盐溶液之间的反应规律,如在溶液中可发生下列反应:Cl2+2KBr=2KCl+Br2
Br2+2KI=2KBr+I2,由此可判断C12、I2、Br2活动性由强到弱顺序是 .
Ⅱ.食盐制碱.我国著名化学家侯德榜发明的联合制碱法的主要过程是:①向浓氨水中通入足量的二氧化碳生成碳酸氢铵溶液;②然后向溶液中加入食盐细粒充分搅拌,控制条件,利用物质的性质不同,两者发生反应生成碳酸氢钠.便有品体析出;③将析出的碳酸氢钠加热制得碳酸钠、二氧化碳和水.
四种盐在不同温度下的溶解度表:
请回答:
(3)过程①中发生反应的化学方程式 ,该反应类型 .
(4)根据溶解度表分析过程②中能发生反应的原因是 ,过程②发生的化学方程式 该反应的类型为 .
(5)过程③中反应的化学方程式是 .
 试回答:
试回答:(1)步骤②中的化学方程式为2NaBr+Cl2=2NaCl+Br2,其反应类型是
(2)非金属单质也具有类似金属与盐溶液之间的反应规律,如在溶液中可发生下列反应:Cl2+2KBr=2KCl+Br2
Br2+2KI=2KBr+I2,由此可判断C12、I2、Br2活动性由强到弱顺序是
Ⅱ.食盐制碱.我国著名化学家侯德榜发明的联合制碱法的主要过程是:①向浓氨水中通入足量的二氧化碳生成碳酸氢铵溶液;②然后向溶液中加入食盐细粒充分搅拌,控制条件,利用物质的性质不同,两者发生反应生成碳酸氢钠.便有品体析出;③将析出的碳酸氢钠加热制得碳酸钠、二氧化碳和水.
四种盐在不同温度下的溶解度表:
| 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| 碳酸氢铵 | 15.8 | 21.0 | 27.0 | ||
| 碳酸氢钠 | 8.1 | 9.6 | 11.1 | 12.7 | |
| 氯化铵 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
(3)过程①中发生反应的化学方程式
(4)根据溶解度表分析过程②中能发生反应的原因是
(5)过程③中反应的化学方程式是
海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还含有大量的化学物质.
I.海水提溴.从海水中提取的溴约占世界溴产量的
,工业上常用“吹出法”制溴,其工艺流程如下:
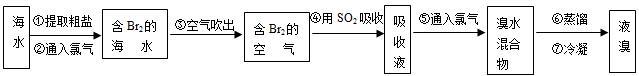
试回答:
(1)步骤②中的化学方程式为2NaBr+Cl2=2NaCl+Br2,其反应类型是 ,
(2)非金属单质也具有类似金属与盐溶液之间的反应规律,如在溶液中可发生下列反应:Cl2+2KBr=2KCl+Br2Br2+2KI=2KBr2+I2
由此可判断Cl2、I2、Br2活动性由强到弱顺序是 .
Ⅱ.食盐制碱.我国著名化学家侯德榜发明的联合制碱法的主要过程是:①向浓氨水中通人足量的二氧化碳生成碳酸氢铵溶液;②然后向溶液中加入食盐细粒充分搅拌,控制条件,利用物质的性质不同,两者发生反应生成碳酸氢钠,便有晶体析出;③将析出的碳酸氢钠加热制得碳酸钠、二氧化碳和水.
四种盐在不同温度下的溶解度表:
请回答:
(1)碳酸氢铵的化学式是 .
(2)由上表分析过程②中能发生反应的原因是 .
(3)过程③中反应的化学方程式是 .
I.海水提溴.从海水中提取的溴约占世界溴产量的
| 1 |
| 3 |

试回答:
(1)步骤②中的化学方程式为2NaBr+Cl2=2NaCl+Br2,其反应类型是
(2)非金属单质也具有类似金属与盐溶液之间的反应规律,如在溶液中可发生下列反应:Cl2+2KBr=2KCl+Br2Br2+2KI=2KBr2+I2
由此可判断Cl2、I2、Br2活动性由强到弱顺序是
Ⅱ.食盐制碱.我国著名化学家侯德榜发明的联合制碱法的主要过程是:①向浓氨水中通人足量的二氧化碳生成碳酸氢铵溶液;②然后向溶液中加入食盐细粒充分搅拌,控制条件,利用物质的性质不同,两者发生反应生成碳酸氢钠,便有晶体析出;③将析出的碳酸氢钠加热制得碳酸钠、二氧化碳和水.
四种盐在不同温度下的溶解度表:
| 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| 碳酸氢铵 | 15.8 | 21.0 | 27.0 | ||
| 碳酸氢钠 | 8.1 | 9.6 | 11.1 | 12.7 | |
| 氯化铵 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
(1)碳酸氢铵的化学式是
(2)由上表分析过程②中能发生反应的原因是
(3)过程③中反应的化学方程式是


