摘要:23.电子工业常用30%的溶液腐蚀敷在塑料板上的铜箔.制成印刷电路板.现拟采用以下实验步骤从使用过的腐蚀废液中回收铜.并重新制得纯净的溶液.请在各步骤的括号内填写适当的试剂或生成物的化学式.
网址:http://m.1010jiajiao.com/timu3_id_247630[举报]
电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板.
(1)检验溶液中Fe3+存在的试剂是 ,证明Fe3+存在的现象是 .
(2)写出FeCl3溶液与金属铜发生反应的离子方程式
(3)某工程师为了从使用过的腐蚀溶液中回收铜,并重新获得FeCl3溶液,准备采用下列步骤:
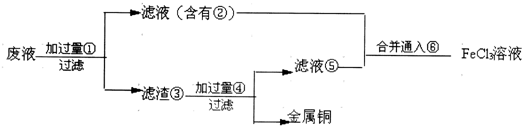
请写出上述实验中加入或生成的有关物质的化学式
① ② ③ ④ ⑤ ⑥ .
查看习题详情和答案>>
(1)检验溶液中Fe3+存在的试剂是
(2)写出FeCl3溶液与金属铜发生反应的离子方程式
(3)某工程师为了从使用过的腐蚀溶液中回收铜,并重新获得FeCl3溶液,准备采用下列步骤:

请写出上述实验中加入或生成的有关物质的化学式
①
电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板.
(1)检验溶液中Fe3+存在的试剂是
(2)欲从腐蚀后的废液中回收铜并重新获得FeCl3溶液.下列试剂中,需要用到的一组是(填字母)
①蒸馏水②铁粉③浓硝酸④浓盐酸⑤浓氨水⑥氯水
A.②④⑥B.③④⑥C.②④⑤D.①④⑥
(3)写出FeCl3溶液与金属铜发生反应的离子方程式
(4)除去FeCl2中混有的FeCl3,可加入
查看习题详情和答案>>
(1)检验溶液中Fe3+存在的试剂是
KSCN溶液
KSCN溶液
,证明Fe3+存在的现象是溶液变为血红色
溶液变为血红色
(2)欲从腐蚀后的废液中回收铜并重新获得FeCl3溶液.下列试剂中,需要用到的一组是(填字母)
A
A
.①蒸馏水②铁粉③浓硝酸④浓盐酸⑤浓氨水⑥氯水
A.②④⑥B.③④⑥C.②④⑤D.①④⑥
(3)写出FeCl3溶液与金属铜发生反应的离子方程式
2Fe3++Cu=Cu2++2Fe2+
2Fe3++Cu=Cu2++2Fe2+
(4)除去FeCl2中混有的FeCl3,可加入
铁粉
铁粉
; 除去FeCl3中混有的FeCl2,可加入Cl2或氯水或H2O2或O3等
Cl2或氯水或H2O2或O3等
,反应的离子方程式为Cl2+2Fe2+=2Fe3++2Cl-或H2O2+2H++2Fe2+=2Fe3++2H2O
Cl2+2Fe2+=2Fe3++2Cl-或H2O2+2H++2Fe2+=2Fe3++2H2O
.电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板.
(1)检验溶液中Fe3+存在的试剂是
(2)写出FeCl3溶液与金属铜发生反应的化学方程式
查看习题详情和答案>>
(1)检验溶液中Fe3+存在的试剂是
KSCN溶液
KSCN溶液
,证明Fe3+存在的现象是溶液变红
溶液变红
.(2)写出FeCl3溶液与金属铜发生反应的化学方程式
2FeCl3+Cu═2FeCl2+CuCl2
2FeCl3+Cu═2FeCl2+CuCl2
.
铁元素是一种重要的金属元素,铁及其化合物间可以相互转化.
(1)检验溶液中Fe3+存在的试剂是 (化学式),证明 Fe3+存在的现象是溶液变红.
(2)电子工业常用30% 的FeCl3溶液腐蚀铜箔,制造印刷电路板.
①写出FeCl3溶液腐蚀铜箔的离子方程式:
②为了从使用过的腐蚀液中回收铜,并重新获得FeCl3溶液,准备采用下列步骤:
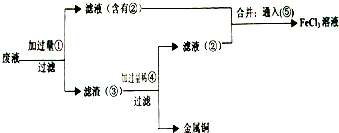
A.写出上述实验中加入或生成的有关物质的化学式:① ② ④
B.写出含有②的滤液与⑤反应的离子方程式
(3)实验室里配制硫酸亚铁溶液常常加入过量的铁粉防止其被氧化,纯净的氢氧化亚铁是白色的沉淀,在空气中长时间存放最终会变为 色,有关的化学方程式为: .
查看习题详情和答案>>
(1)检验溶液中Fe3+存在的试剂是
(2)电子工业常用30% 的FeCl3溶液腐蚀铜箔,制造印刷电路板.
①写出FeCl3溶液腐蚀铜箔的离子方程式:
②为了从使用过的腐蚀液中回收铜,并重新获得FeCl3溶液,准备采用下列步骤:

A.写出上述实验中加入或生成的有关物质的化学式:①
B.写出含有②的滤液与⑤反应的离子方程式
(3)实验室里配制硫酸亚铁溶液常常加入过量的铁粉防止其被氧化,纯净的氢氧化亚铁是白色的沉淀,在空气中长时间存放最终会变为
电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板.废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费,应考虑回收利用.按如下流程在实验室进行实验:从废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用.
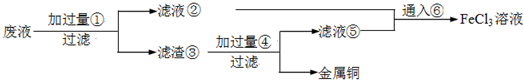
(1)写出FeCl3溶液与铜箔发生反应的化学方程式:
(2)检验废腐蚀液中含有Fe3+的实验操作是
(3)“过滤”用到的玻璃仪器有:普通漏斗、
(4)废液中加入过量①后,发生反应的离子方程式:
(5)上述流程中取废液200mL,其中含CuCl2 1.5mol?L-1、FeCl2 3.0mol?L-1、FeCl3 1.0mol?L-1,若要将铜全部回收,需加入Fe粉的质量应不少于
(6)某化学兴趣小组利用在下图装置制取氯气并通入到FeCl2溶液中获得FeCl3溶液.
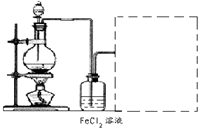
制备Cl2的化学方程式为:
该装置不完整,请在所给虚线框内画出所缺部分,并标注试剂.
查看习题详情和答案>>

(1)写出FeCl3溶液与铜箔发生反应的化学方程式:
2FeCl3+Cu=2FeCl2+CuCl2
2FeCl3+Cu=2FeCl2+CuCl2
.(2)检验废腐蚀液中含有Fe3+的实验操作是
取少量废腐蚀液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+
取少量废腐蚀液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+
.(3)“过滤”用到的玻璃仪器有:普通漏斗、
玻璃棒、烧杯
玻璃棒、烧杯
.(4)废液中加入过量①后,发生反应的离子方程式:
2Fe3++Fe=3Fe2+Cu2++Fe=Fe2++Cu
2Fe3++Fe=3Fe2+Cu2++Fe=Fe2++Cu
.(5)上述流程中取废液200mL,其中含CuCl2 1.5mol?L-1、FeCl2 3.0mol?L-1、FeCl3 1.0mol?L-1,若要将铜全部回收,需加入Fe粉的质量应不少于
22.4
22.4
g;将铁的化合物全部转化为FeCl3溶液需通入Cl2的物质的量不少于0.6
0.6
mol.(6)某化学兴趣小组利用在下图装置制取氯气并通入到FeCl2溶液中获得FeCl3溶液.

制备Cl2的化学方程式为:
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
.
| ||
该装置不完整,请在所给虚线框内画出所缺部分,并标注试剂.