摘要:溶解度与溶质的质量分数的比较: 比较项目 溶 解 度 溶质的质量分数 意 义 温度要求 溶剂量要求 溶液是否饱和 单 位 两者联系
网址:http://m.1010jiajiao.com/timu3_id_24708[举报]
比较是一种重要的学习方法,通过观察,分析,找出研究对象的相同点和不同点,它是认识事物的一种基本方法.
(1)完成下表中二氧化碳和氧气制取实验及相关性质比较:
(2)干粉灭火器的原理是碳酸钠加热分解产生碳酸钠、二氧化碳和水(2NaHCO3
Na2CO3+H2O+CO2↑),若实验室用此反应制取二氧化碳,可用上图中的
(3)某厂生产的产品碳酸钠中混有少量碳酸氢钠.为了测定产品中碳酸钠的质量分数,取100g样品加热(碳酸钠受热不分解),完全分解生成二氧化碳气体0.22g.求:
①样品中碳酸氢钠的质量.
②样品中碳酸钠的质量分数.
查看习题详情和答案>>
(1)完成下表中二氧化碳和氧气制取实验及相关性质比较:
| 气体名称 | 实验装置图 | 反应物状态 | 反应条件 | 气体密度比空气大或小 | 是否与水反应或溶解于水 |
| 二氧化碳 | 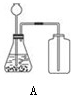 |
常温 | |||
| 氧气 | 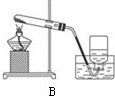 |
不易溶于水 |
| ||
B
B
(填A或B)装置.(3)某厂生产的产品碳酸钠中混有少量碳酸氢钠.为了测定产品中碳酸钠的质量分数,取100g样品加热(碳酸钠受热不分解),完全分解生成二氧化碳气体0.22g.求:
①样品中碳酸氢钠的质量.
②样品中碳酸钠的质量分数.
比较是一种重要的学习方法,通过观察,分析,找出研究对象的相同点和不同点,它是认识事物的一种基本方法.
(1)完成下表中二氧化碳和氧气制取实验及相关性质比较:
(2)干粉灭火器的原理是碳酸钠加热分解产生碳酸钠、二氧化碳和水(2NaHCO3 Na2CO3+H2O+CO2↑),若实验室用此反应制取二氧化碳,可用上图中的______(填A或B)装置.
Na2CO3+H2O+CO2↑),若实验室用此反应制取二氧化碳,可用上图中的______(填A或B)装置.
(3)某厂生产的产品碳酸钠中混有少量碳酸氢钠.为了测定产品中碳酸钠的质量分数,取100g样品加热(碳酸钠受热不分解),完全分解生成二氧化碳气体0.22g.求:
①样品中碳酸氢钠的质量.
②样品中碳酸钠的质量分数.
查看习题详情和答案>>
(1)完成下表中二氧化碳和氧气制取实验及相关性质比较:
| 气体名称 | 实验装置图 | 反应物状态 | 反应条件 | 气体密度比空气大或小 | 是否与水反应或溶解于水 |
| 二氧化碳 |  | 常温 | |||
| 氧气 |  | 不易溶于水 |
 Na2CO3+H2O+CO2↑),若实验室用此反应制取二氧化碳,可用上图中的______(填A或B)装置.
Na2CO3+H2O+CO2↑),若实验室用此反应制取二氧化碳,可用上图中的______(填A或B)装置.(3)某厂生产的产品碳酸钠中混有少量碳酸氢钠.为了测定产品中碳酸钠的质量分数,取100g样品加热(碳酸钠受热不分解),完全分解生成二氧化碳气体0.22g.求:
①样品中碳酸氢钠的质量.
②样品中碳酸钠的质量分数.
查看习题详情和答案>>
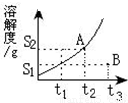
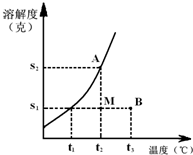 某固体物质的溶解度曲线如图所示,根据图回答如下问题:
某固体物质的溶解度曲线如图所示,根据图回答如下问题:(1)图中B点的意义:表示该物质在t3℃时,每100g溶剂和S1g溶质形成不饱和溶液.A点的意义:
表示该物质在t2℃时,每100g溶剂和S2g溶质形成饱和溶液
表示该物质在t2℃时,每100g溶剂和S2g溶质形成饱和溶液
.此溶液的溶质质量分数的表达式W(B)═[S2/(100+S2)]×100%
W(B)═[S2/(100+S2)]×100%
.(2)若A、B两点的溶液在保持温度不变的情况下各加20克水,A点的溶解度将
不变
不变
(填“增大”、“减小”、或“不变”);A、B的溶质质量分数前者大
前者大
(填“前者大”、“后者大”或“相等”).(3)当温度降低时,A点变动后溶液的质量分数与原来比较
减小
减小
(填“增大”、“减小”或“不变”).(4)若使M点的(100+S1)g溶液成为饱和溶液的方法:降温至
t1
t1
℃;增加溶质S2-S1
S2-S1
g和蒸发溶剂
蒸发溶剂
.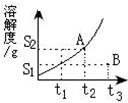 某固体物质的溶解度曲线如图所示,试根据图回答下列问题:
某固体物质的溶解度曲线如图所示,试根据图回答下列问题: