题目内容
比较是一种重要的学习方法,通过观察,分析,找出研究对象的相同点和不同点,它是认识事物的一种基本方法.
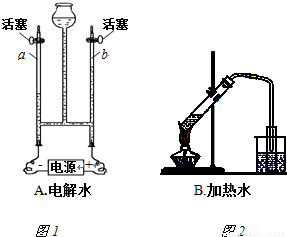
(1)完成下表中二氧化碳和氧气制取实验及相关性质比较:
(2)干粉灭火器的原理是碳酸钠加热分解产生碳酸钠、二氧化碳和水(2NaHCO3
Na2CO3+H2O+CO2↑),若实验室用此反应制取二氧化碳,可用上图中的
(3)某厂生产的产品碳酸钠中混有少量碳酸氢钠.为了测定产品中碳酸钠的质量分数,取100g样品加热(碳酸钠受热不分解),完全分解生成二氧化碳气体0.22g.求:
①样品中碳酸氢钠的质量.
②样品中碳酸钠的质量分数.
(1)完成下表中二氧化碳和氧气制取实验及相关性质比较:
| 气体名称 | 实验装置图 | 反应物状态 | 反应条件 | 气体密度比空气大或小 | 是否与水反应或溶解于水 |
| 二氧化碳 |  |
常温 | |||
| 氧气 |  |
不易溶于水 |
| ||
B
B
(填A或B)装置.(3)某厂生产的产品碳酸钠中混有少量碳酸氢钠.为了测定产品中碳酸钠的质量分数,取100g样品加热(碳酸钠受热不分解),完全分解生成二氧化碳气体0.22g.求:
①样品中碳酸氢钠的质量.
②样品中碳酸钠的质量分数.
分析:(1)根据实验室中制取二氧化碳和氧气的反应原理及二氧化碳和氧气的性质来完成解答即可;
(2)根据装置的适用范围来完成解答;
(3)①根据生成的二氧化碳的质量求算出样品中碳酸氢钠的质量;
②根据①中的计算可以求算出碳酸钠的质量,进而计算出碳酸钠的质量分数.
(2)根据装置的适用范围来完成解答;
(3)①根据生成的二氧化碳的质量求算出样品中碳酸氢钠的质量;
②根据①中的计算可以求算出碳酸钠的质量,进而计算出碳酸钠的质量分数.
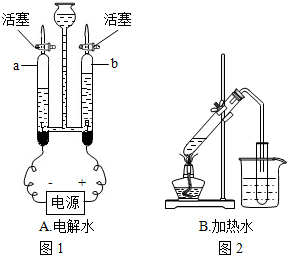
解答:解:(1)实验室中用大理石和稀盐酸来制取二氧化碳,其中大理石为固体,而稀盐酸为液体,该反应在常温下即可反应,二氧化碳的密度比空气大且能够溶于水;而实验室中在用图中所给的加热的方法来制取氧气时,通常选择氯酸钾来制取,氯酸钾为固体,氧气的密度比空气大且难溶于水;
(2)根据题给的信息可以知道,该反应需要加热,所以应该选择B装置;
(3)①设样品中碳酸氢钠的质量为x
2NaHCO3
Na2CO3+H2O+CO2↑
168 44
x 0.22g
=
解得:x=0.84g
②样品中碳酸钠的质量分数为:
×100%=99.16%
答:①样品中碳酸氢钠的质量为0.84g.
②样品中碳酸钠的质量分数99.16%.
故答案为:(1)
(2)B;
(3)①0.84g;
②99.16%.
(2)根据题给的信息可以知道,该反应需要加热,所以应该选择B装置;
(3)①设样品中碳酸氢钠的质量为x
2NaHCO3
| ||
168 44
x 0.22g
| 168 |
| x |
| 44 |
| 0.22g |
解得:x=0.84g
②样品中碳酸钠的质量分数为:
| 100g-0.84g |
| 100g |
答:①样品中碳酸氢钠的质量为0.84g.
②样品中碳酸钠的质量分数99.16%.
故答案为:(1)
| 气体名称 | 实验装置图 | 反应物状态 | 反应条件 | 气体密度比空气大或小 | 是否与水反应或溶解于水 |
| 二氧化碳 |  |
固体和液体 | 常温 | 大 | 能溶于水 |
| 氧气 |  |
固体 | 加热 | 大 | 不易溶于水 |
(3)①0.84g;
②99.16%.
点评:在实际学习过程中要学会运用类比的方法学习二氧化碳和氧气的实验室制法及反应原理,以及二者的检验和验满.

练习册系列答案
相关题目
比较是一种重要的学习方法,通过观察,分析,找出研究对象的相同点和不同点,它是认识事物的一种基本方法.
(1)完成下表中二氧化碳和氧气制取实验及相关性质比较:
(2)干粉灭火器的原理是碳酸钠加热分解产生碳酸钠、二氧化碳和水(2NaHCO3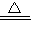 Na2CO3+H2O+CO2↑),若实验室用此反应制取二氧化碳,可用上图中的______(填A或B)装置.
Na2CO3+H2O+CO2↑),若实验室用此反应制取二氧化碳,可用上图中的______(填A或B)装置.
(3)某厂生产的产品碳酸钠中混有少量碳酸氢钠.为了测定产品中碳酸钠的质量分数,取100g样品加热(碳酸钠受热不分解),完全分解生成二氧化碳气体0.22g.求:
①样品中碳酸氢钠的质量.
②样品中碳酸钠的质量分数.
(1)完成下表中二氧化碳和氧气制取实验及相关性质比较:
| 气体名称 | 实验装置图 | 反应物状态 | 反应条件 | 气体密度比空气大或小 | 是否与水反应或溶解于水 |
| 二氧化碳 |  | 常温 | |||
| 氧气 |  | 不易溶于水 |
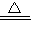 Na2CO3+H2O+CO2↑),若实验室用此反应制取二氧化碳,可用上图中的______(填A或B)装置.
Na2CO3+H2O+CO2↑),若实验室用此反应制取二氧化碳,可用上图中的______(填A或B)装置.(3)某厂生产的产品碳酸钠中混有少量碳酸氢钠.为了测定产品中碳酸钠的质量分数,取100g样品加热(碳酸钠受热不分解),完全分解生成二氧化碳气体0.22g.求:
①样品中碳酸氢钠的质量.
②样品中碳酸钠的质量分数.
 学习化学知识后,物质世界可用化学视角观察了.水是一种重要的物质,在日常生活和实验室中有着不可替代的作用.
学习化学知识后,物质世界可用化学视角观察了.水是一种重要的物质,在日常生活和实验室中有着不可替代的作用.
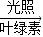 6O2+X
6O2+X