摘要:下列说法正确的是: A 1摩O的质量是16g/mol B Na+的摩尔质量为22g/mol C CO2的摩尔质量是44 g/mol D 1摩N2的质量是14 g
网址:http://m.1010jiajiao.com/timu3_id_242262[举报]
如图1是煤化工产业链的一部分,试运用所学知识,解决下列问题:

(1)已知该产业链中某反应的平衡表达式为:K=
它所对应的化学反应为:
(2)已知在一定温度下,各反应的平衡常数如下:
C(s)+CO2(g)?2CO(g),K1 ①
CO(g)+H2O(g)?H2(g)+CO2(g),K2 ②
C(s)+H2O(g)?CO(g)+H2(g),K3 ③
则K1、K2、K3,之间的关系是:
反应①的平衡常数K随温度的升高而
一定温度下,在三个容积均为2L的容器中均进行着③反应,各物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中相应的空格.
简述理由:
(3)该产业链中氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等.对反应N2O4(g)?2NO2(g)△H>O,在温度为T1、T2时,平衡体系中N02的体积分数随压强变化曲线如图2所示.下列说法正确的是
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
(4)如果(3)中的反应达到平衡后,改变某一外界条件(不改变N2O4、NO2的量),反应速率v与时间t关系如右图所示.图中t4时引起平衡移动的条件可能是
查看习题详情和答案>>

(1)已知该产业链中某反应的平衡表达式为:K=
| [H2][CO] |
| [H2O] |
它所对应的化学反应为:
C(s)+H2O(g)?CO(g)+H2(g)
C(s)+H2O(g)?CO(g)+H2(g)
(2)已知在一定温度下,各反应的平衡常数如下:
C(s)+CO2(g)?2CO(g),K1 ①
CO(g)+H2O(g)?H2(g)+CO2(g),K2 ②
C(s)+H2O(g)?CO(g)+H2(g),K3 ③
则K1、K2、K3,之间的关系是:
K3=K1×K2
K3=K1×K2
.反应①的平衡常数K随温度的升高而
增大
增大
(增大/减小/不变).一定温度下,在三个容积均为2L的容器中均进行着③反应,各物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中相应的空格.
| 容器编号 | n(C)mol | n(H2O)mol | n(CO)mol | n(H2)mol | v正、v逆比较 |
| Ⅰ | 0.2 | 0.12 | 1.20 | 0.20 | v正=v逆 |
| Ⅱ | 0.16 | 0.20 | 0.40 | 0.80 | v正 > > v逆 |
Q=
=0.8<1=K,Q<K 平衡向正方向进行,所以v正>v逆
| 0.2×0.4 |
| 0.1 |
Q=
=0.8<1=K,Q<K 平衡向正方向进行,所以v正>v逆
| 0.2×0.4 |
| 0.1 |
(3)该产业链中氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等.对反应N2O4(g)?2NO2(g)△H>O,在温度为T1、T2时,平衡体系中N02的体积分数随压强变化曲线如图2所示.下列说法正确的是
D
D
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
(4)如果(3)中的反应达到平衡后,改变某一外界条件(不改变N2O4、NO2的量),反应速率v与时间t关系如右图所示.图中t4时引起平衡移动的条件可能是
增大压强
增大压强
;图中表示平衡混合物中NO2的含量最高的一段时间是t3~t4
t3~t4
.(2013?徐州模拟)某温度下,反应2A(g)
|
查看习题详情和答案>>
一定温度下,在一固定体积的容器中,通人一定量的CO和H2O,发生反应:
CO(g)十H2O(g)?CO2(g)十H2 (g)△H<0.在850℃时,CO和H2O浓度变化如图;若在t1℃时,在相同容器中发生上述反应,容器内各物质的浓度变化如表.下列说法正确的是:( )

CO(g)十H2O(g)?CO2(g)十H2 (g)△H<0.在850℃时,CO和H2O浓度变化如图;若在t1℃时,在相同容器中发生上述反应,容器内各物质的浓度变化如表.下列说法正确的是:( )

| A、850℃时,按左图所示0~4min用CO2表示的平均反应速率v(CO2)=0.02mol?L-1?min-1 | B、t1℃高于850℃ | C、t1℃时,反应在4min~5min间,平衡向逆反应方向移动,若其它条件不变,可能的原因是增大压强 | D、若t2℃时,各物质的平衡浓度符合c(CO2)?c(H2)=2[c(CO)?c(H2O)],则t2℃高于850℃ |
 本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应和答题区域内作答.若两题都做,则按A题评分.
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应和答题区域内作答.若两题都做,则按A题评分.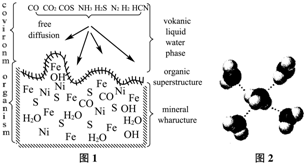
A.海底热液研究(图1)处于当今科研的前沿.海底热液活动区域“黑烟囱”的周围常存在FeS、黄铜矿及锌矿等矿物.
(1)Ni2+的核外电子排布式是
(2)分析下表,铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,基主要原因是
| 电离能/kJ?mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
A.电负性:N>O>S>C B.CO2与COS(硫化羰)互为等电子体
C.NH3分子中氮原子采用sp3杂化 D.CO、H2S、HCN都是极性分子
(4)“酸性热液”中大量存在一价阳离子,结构如图2,它的化学式为
(5)FeS与NaCl均为离子晶体,晶胞相似,前者熔点为985℃,后者801℃,其原因是
B.制备KNO3晶体的实质是利用结晶和重结晶法对KNO3和NaCl的混合物进行分离.下面是某化学兴趣小组的活动记录:
| NaNO3 | KNO3 | NaCl | KCl | |
| 10℃ | 80.5 | 20.9 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |
实验方案:
Ⅰ.溶解:称取29.8g KCl和34.0g NaNO3放入250mL烧杯中,再加入70.0g蒸馏水,加热并搅拌,使固体全部溶解.
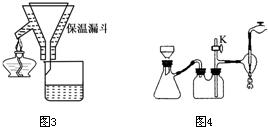
Ⅱ.蒸发结晶:继续加热和搅拌,将溶液蒸发浓缩.在100℃时蒸发掉50.0g 水,维持该温度,在保温漏斗(如图3所示)中趁热过滤析出的晶体.得晶体m1g.
Ⅲ.冷却结晶:待溶液冷却至室温(实验时室温为10℃)后,进行减压过滤.得KNO3粗产品m2g.
Ⅳ.重结晶:将粗产品全部溶于水,制成100℃的饱和溶液,冷却至室温后抽滤.得KNO3纯品.
假定:①盐类共存时不影响各自的溶解度;②各种过滤操作过程中,溶剂的损耗忽略不计.试回答有关问题:
(1)操作Ⅱ中趁热过滤的目的是.
(2)若操作Ⅱ中承接滤液的烧杯中不加入蒸馏水,则理论上在操作Ⅲ中可得粗产品的质量m2=
(3)操作Ⅲ中采用减压过滤,其优点是
 碳是形成化合物最多的元素.
碳是形成化合物最多的元素.(1)由碳元素参与形成的物质多为分子晶体,也有少数原子晶体.下列关于分子晶体和原子晶体的说法正确的是
A、完全由非金属元素形成的物质一定是分子晶体或原子晶体
B、分子晶体中分子之间一定存在范德华力
C、SiC具有极高的熔点和较大的硬度,SiC分子中除存在共价键外,还存在分子间作用力
D、金刚石是由碳元素形成的原子晶体,性质稳定,不与任何物质反应
(2)意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的C4分子.C4分子结构如图所示.下列说法正确的是
A、C4属于一种新型的化合物 B、C4与P4(白磷)的晶体都属于分子晶体
C、C4气体分子内含有极性共价键 D、C4与C60互为同素异形
(3)与碳同主族元素锗为32号元素,与锗同周期,且未成对电子数与锗相同,电负性最大的元素的价电子排布式为
(4)邻硝基苯酚的熔点
(5)硼、碳、氮、氧是元素周期表第二周期相邻的四种元素.下列有关的四种化合
物中,键角最小的是
A、CO2 B、CF4 C、NF3 D、OF2
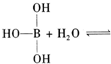
已知硼酸H3BO3为白色固体,溶于水显弱酸性,但它却是一元酸,可以用硼酸在水溶液中的电离平衡解释它是一元弱酸的原因.
请写出下面这个方程式右端的两种离子的表达式:
 查看习题详情和答案>>
查看习题详情和答案>>