题目内容
 碳是形成化合物最多的元素.
碳是形成化合物最多的元素.(1)由碳元素参与形成的物质多为分子晶体,也有少数原子晶体.下列关于分子晶体和原子晶体的说法正确的是
A、完全由非金属元素形成的物质一定是分子晶体或原子晶体
B、分子晶体中分子之间一定存在范德华力
C、SiC具有极高的熔点和较大的硬度,SiC分子中除存在共价键外,还存在分子间作用力
D、金刚石是由碳元素形成的原子晶体,性质稳定,不与任何物质反应
(2)意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的C4分子.C4分子结构如图所示.下列说法正确的是
A、C4属于一种新型的化合物 B、C4与P4(白磷)的晶体都属于分子晶体
C、C4气体分子内含有极性共价键 D、C4与C60互为同素异形
(3)与碳同主族元素锗为32号元素,与锗同周期,且未成对电子数与锗相同,电负性最大的元素的价电子排布式为
(4)邻硝基苯酚的熔点
(5)硼、碳、氮、氧是元素周期表第二周期相邻的四种元素.下列有关的四种化合
物中,键角最小的是
A、CO2 B、CF4 C、NF3 D、OF2
已知硼酸H3BO3为白色固体,溶于水显弱酸性,但它却是一元酸,可以用硼酸在水溶液中的电离平衡解释它是一元弱酸的原因.
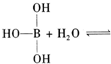
请写出下面这个方程式右端的两种离子的表达式:
分析:(1)A、氯化铵由非金属元素组成,但属于离子晶体;
B、分子晶体中分子间的作用力为范德华力和氢键;
C、SiC为原子晶体,只存在共价键,无范德华力;
D、金刚石在一定条件下可发生一些化学反应,如金刚石转化为石墨等;
(2)A、C4是由C组成的单质;
B、C4和白磷一样,分子间存在范德华力;
C、C4中的共价键是由碳原子构成的非极性键;
D、由相同元素组成的形态不同的单质;
(3)Ge的价电子排布为4s24p2,含有2个未成对电子,Se的价电子排布为4s24p4,含有2个未成对电子,且在同周期含有2个未成对电子的元素中电负性最大;
(4)形成分子间氢键熔沸点比形成分子内氢键的熔沸点更高;
(5)所含孤电子对越多,键角越小;硼酸是一元酸,电离得到氢离子和硼酸二氢根离子.
B、分子晶体中分子间的作用力为范德华力和氢键;
C、SiC为原子晶体,只存在共价键,无范德华力;
D、金刚石在一定条件下可发生一些化学反应,如金刚石转化为石墨等;
(2)A、C4是由C组成的单质;
B、C4和白磷一样,分子间存在范德华力;
C、C4中的共价键是由碳原子构成的非极性键;
D、由相同元素组成的形态不同的单质;
(3)Ge的价电子排布为4s24p2,含有2个未成对电子,Se的价电子排布为4s24p4,含有2个未成对电子,且在同周期含有2个未成对电子的元素中电负性最大;
(4)形成分子间氢键熔沸点比形成分子内氢键的熔沸点更高;
(5)所含孤电子对越多,键角越小;硼酸是一元酸,电离得到氢离子和硼酸二氢根离子.
解答:解:(1)A、氯化铵由非金属元素组成,但属于离子晶体,故A错误;
B、分子晶体中分子间的作用力为范德华力和氢键,一定存在范德华力,同时可能含有氢键,故B正确;
C、SiC具有极高的熔点和较大的硬度,说明SiC为原子晶体,只存在共价键,无范德华力,故C错误;
D、金刚石在一定条件下可发生一些化学反应,如金刚石转化为石墨、与氧气发生氧化等,故D错误;
故答案为:B;
(2)A、C4是由C组成的单质,故A错误;
B、C4和白磷一样,分子间存在范德华力,均属于分子晶体,故B正确;
C、C4中的共价键是由碳原子构成的非极性键,故C错误;
D、C4与C60都是由碳元素组成的不同的单质,互为同素异形体,故D正确;
故答案为:BD;
(3)Ge的价电子排布为4s24p2,含有2个未成对电子,Se的价电子排布为4s24p4,含有2个未成对电子,且在同周期含有2个未成对电子的元素中电负性最大,
故答案为:4s24p4;
(4)邻硝基苯酚形成分子内氢键,对硝基苯酚形成分子间氢键,形成分子间氢键熔沸点比形成分子内氢键的熔沸点更高,
故答案为<;
(5)A、CO2不含孤电子对,为直线形,键角180°;
B、CF4不含孤电子对,为正四面体,键角109°28′;
C、NF3为三角锥形,含1个孤电子对,键角约107°18′;
D、OF2为V形,含2个孤电子对,键角约为104.5°.
硼酸是一元酸,电离得到氢离子和硼酸二氢根离子,方程式为:
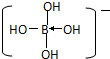 +H+
+H+
故答案为:D; +H+.
+H+.
B、分子晶体中分子间的作用力为范德华力和氢键,一定存在范德华力,同时可能含有氢键,故B正确;
C、SiC具有极高的熔点和较大的硬度,说明SiC为原子晶体,只存在共价键,无范德华力,故C错误;
D、金刚石在一定条件下可发生一些化学反应,如金刚石转化为石墨、与氧气发生氧化等,故D错误;
故答案为:B;
(2)A、C4是由C组成的单质,故A错误;
B、C4和白磷一样,分子间存在范德华力,均属于分子晶体,故B正确;
C、C4中的共价键是由碳原子构成的非极性键,故C错误;
D、C4与C60都是由碳元素组成的不同的单质,互为同素异形体,故D正确;
故答案为:BD;
(3)Ge的价电子排布为4s24p2,含有2个未成对电子,Se的价电子排布为4s24p4,含有2个未成对电子,且在同周期含有2个未成对电子的元素中电负性最大,
故答案为:4s24p4;
(4)邻硝基苯酚形成分子内氢键,对硝基苯酚形成分子间氢键,形成分子间氢键熔沸点比形成分子内氢键的熔沸点更高,
故答案为<;
(5)A、CO2不含孤电子对,为直线形,键角180°;
B、CF4不含孤电子对,为正四面体,键角109°28′;
C、NF3为三角锥形,含1个孤电子对,键角约107°18′;
D、OF2为V形,含2个孤电子对,键角约为104.5°.
硼酸是一元酸,电离得到氢离子和硼酸二氢根离子,方程式为:

 +H+
+H+故答案为:D;
 +H+.
+H+.点评:本题考查较为综合,涉及晶体的机构、组成和性质、核外电子排布、氢键对熔沸点的影响等知识点,掌握晶体的结构和性质是解题的关键.

练习册系列答案
相关题目
 Ⅰ.(1)碳是形成化合物最多的元素,其单质与化合物广布于自然界.CS2是一种重要的有机溶剂,其结构与CO2相似,CS2分子中中心原子的杂化类型为
Ⅰ.(1)碳是形成化合物最多的元素,其单质与化合物广布于自然界.CS2是一种重要的有机溶剂,其结构与CO2相似,CS2分子中中心原子的杂化类型为 ;
;
 (2)CS2是一种重要的有机溶剂,CS2分子的空间构型为 ;写出一种与CS2互为等电子体的物质的化学式 ;
(2)CS2是一种重要的有机溶剂,CS2分子的空间构型为 ;写出一种与CS2互为等电子体的物质的化学式 ;