网址:http://m.1010jiajiao.com/timu3_id_238766[举报]
Ⅰ.通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。下表为一些化学键的键能数据
| 化学键 | Si-Si | O=O | Si-O |
| 键能/kJ·mol-1 | a | b | c |
写出硅高温燃烧的热化学方程式 。
Ⅱ.利用太阳光分解水制氢是未来解决能源危机的理想方法之一。某研究小组设计了如右图所示的循环系统实现光分解水制氢。反应过程中所需的电能由太阳能光电池提供,反应体系中I2和Fe3+等可循环使用。写出下列电解池中总反应的离子方程式:
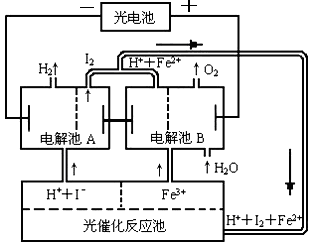
电解池A 。
电解池B 。
(2)若电解池A中生成3.36 L H2(标准状况),计算电解池B中生成Fe2+的物质的量为 mol。
Ⅲ.在一定的温度下,把2体积N2和6体积H2分别通入一个带活塞的体积可变的容器中,活塞的一端与大气相通容器中发生如下反应:N2(g)+3H2(g)
 2NH3(g);△H<0,反应达到平衡后,测得混合气体为7体积。
2NH3(g);△H<0,反应达到平衡后,测得混合气体为7体积。
请据此回答下列问题:
(1)保持上述反应温度不变,设a、b、c分别表示加入的N2、H2 和NH3的体积,如果反应达到平衡后混合气体中各物质的量仍与上述平衡时完全相同。
①a=1,c=2,则b= 。在此情况下,反应起始时将向 反应方向(填“正”或“逆”)进行。
②若需规定起始时反应向逆方向进行,则c的取值范围是 。
(2)在上述恒压装置中,若需控制平衡后混合气体为6.5体积,则可采取的措施是 ,原因是 。 查看习题详情和答案>>
| 化学键 | Si-Si | O=O | Si-O |
| 键能/kJ·mol-1 | a | b | c |
写出硅高温燃烧的热化学方程式 。
Ⅱ.利用太阳光分解水制氢是未来解决能源危机的理想方法之一。某研究小组设计了如右图所示的循环系统实现光分解水制氢。反应过程中所需的电能由太阳能光电池提供,反应体系中I2和Fe3+等可循环使用。写出下列电解池中总反应的离子方程式:

电解池A 。
电解池B 。
(2)若电解池A中生成3.36 L H2(标准状况),计算电解池B中生成Fe2+的物质的量为 mol。
Ⅲ.在一定的温度下,把2体积N2和6体积H2分别通入一个带活塞的体积可变的容器中,活塞的一端与大气相通容器中发生如下反应:N2(g)+3H2(g)
 2NH3(g);△H<0,反应达到平衡后,测得混合气体为7体积。
2NH3(g);△H<0,反应达到平衡后,测得混合气体为7体积。
请据此回答下列问题:
(1)保持上述反应温度不变,设a、b、c分别表示加入的N2、H2 和NH3的体积,如果反应达到平衡后混合气体中各物质的量仍与上述平衡时完全相同。
①a=1,c=2,则b= 。在此情况下,反应起始时将向 反应方向(填“正”或“逆”)进行。
②若需规定起始时反应向逆方向进行,则c的取值范围是 。
(2)在上述恒压装置中,若需控制平衡后混合气体为6.5体积,则可采取的措施是 ,原因是 。
(1)在200℃、101 kPa时,1 g H2与碘蒸气完全反应放出7.45 kJ的热量,请写出该反应的热化学方程式________.
(2)在1×105 Pa和298 K时,将拆开1 mol共价键所需要的能量称为键能(kJ/mol).下面是一些共价键的键能:
在298 K时,在催化剂存在下,H2(g)+Cl2(g)=2HCl(g) ΔH=________kJ/mol
(3)已知:CO(g)+2H2(g)![]() CH3OH(g) ΔH1=-116 kJ·mol-1
CH3OH(g) ΔH1=-116 kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) ΔH2=-283 kJ·mol-1
O2(g)=CO2(g) ΔH2=-283 kJ·mol-1
H2(g)+![]() O2(g)=H2O(g) ΔH3=-242 kJ·mol-1
O2(g)=H2O(g) ΔH3=-242 kJ·mol-1
则表示1 mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为:
________.
(4)N2(g)+3H2(g)![]() 2NH3(g)反应过程的能量变化如图所示.已知2 mol N2(g)反应生成4 mol NH3(g)放出-188.4 kJ/mol.则:
2NH3(g)反应过程的能量变化如图所示.已知2 mol N2(g)反应生成4 mol NH3(g)放出-188.4 kJ/mol.则:

图中E的大小对该反应的反应热有无影响?________.(填“有影响”或“无影响”).该反应通常用铁触媒作催化剂,加铁触媒会使图中B点升高还是降低?________(填“升高”或“降低”).图中ΔH=________kJ/mol.对于达平衡后的该反应,若只改变下列条件之一,能使单位体积内活化分子百分数增加的是________.
A.升温
B.再充入N2和H2,并使它们的浓度都增加一倍
C.减压
D.加催化剂
(6分)(1)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJ/mol,H—H键的键能是436.0 kJ/mol;由N2和H2合成1 mol NH3时可放出46.2 kJ的热量。则N—H键的键能是_______________________。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学方程式:
Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g)ΔH=-24.8 kJ/mol ①
3Fe2O3(s)+CO(g) = 2Fe3O4(s)+CO2(g)ΔH=-47.2 kJ/mol ②
Fe3O4(s)+CO(g) = 3FeO(s)+CO2(g)ΔH=+640.5 kJ/mol ③
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学方程式______________________________。
(3)已知两个热化学方程式:
C(s)+O2(g)=CO2(g) △H= ―393.5kJ/mol
2H2(g)+O2(g)=2H2O(g) △H= ―483.6kJ/mol
现有炭粉和H2组成的悬浮气共0.2mol,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是 .
查看习题详情和答案>>
(6分)(1)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJ/mol,H—H键的键能是436.0 kJ/mol;由N2和H2合成1 mol NH3时可 放出46.2 kJ的热量。则N—H键的键能是_______________________。
放出46.2 kJ的热量。则N—H键的键能是_______________________。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学方程式:
Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol ①
3Fe2O3(s)+CO(g) = 2Fe3O4(s)+CO2(g) ΔH=-47.2 kJ/mol ②
Fe3O4(s)+CO(g) = 3FeO(s)+CO2(g) ΔH=+640 .5 kJ/mol ③
.5 kJ/mol ③
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学方程式______________________________。
(3)已知两个热化学方程式:
C(s)+O2(g)=CO2 (g) △H= ― 393.5kJ/mol
(g) △H= ― 393.5kJ/mol
2H2(g)+O2(g )=2H2O(g) △H= ― 483.6kJ/mol
)=2H2O(g) △H= ― 483.6kJ/mol
现有炭粉和H2组成的悬浮气共0.2mol,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是 .